To tylko jedna z 29 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
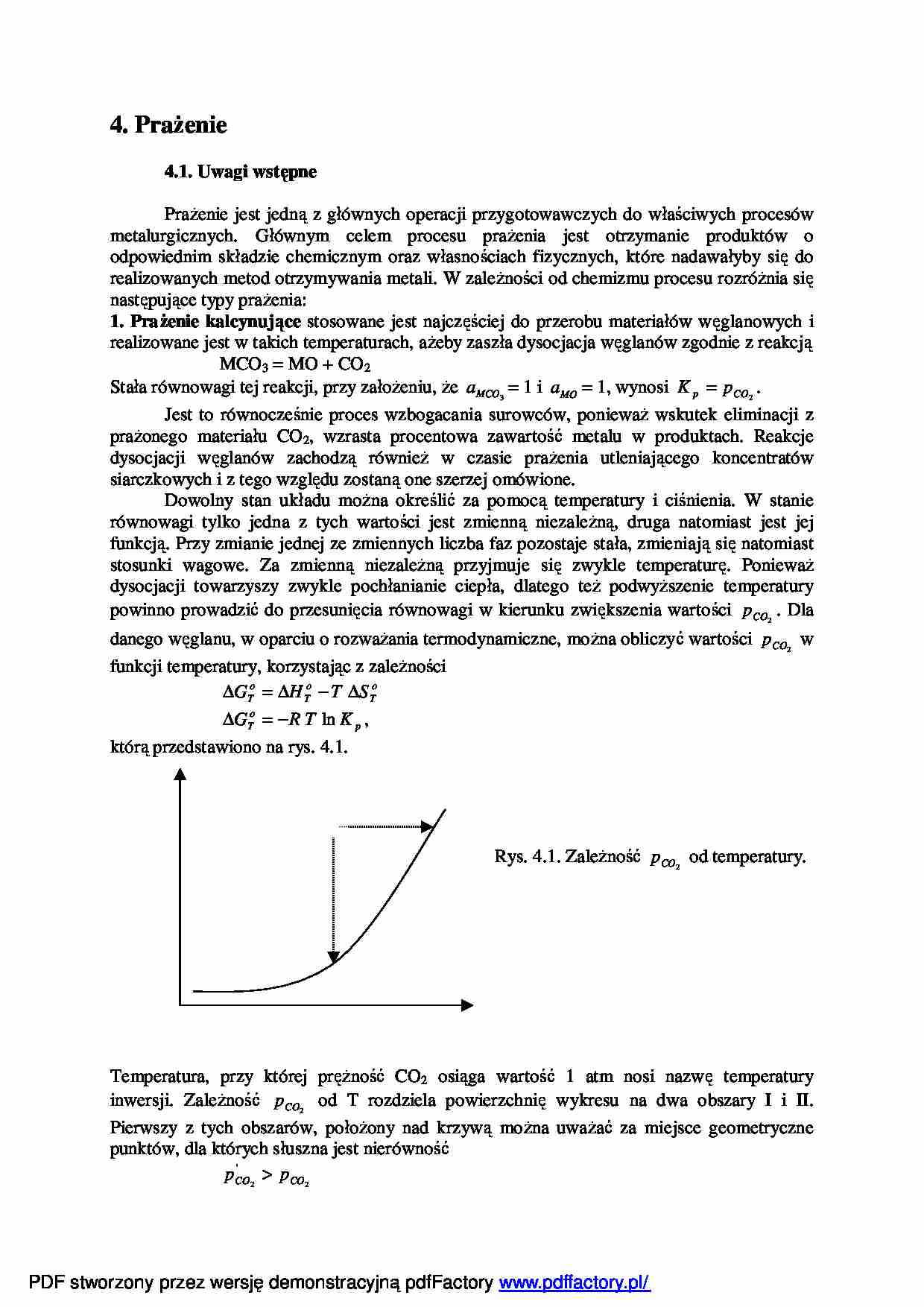


4. Prażenie 4.1. Uwagi wstępne Prażenie jest jedną z głównych operacji przygotowawczych do właściwych procesów metalurgicznych. Głównym celem procesu prażenia jest otrzymanie produktów o odpowiednim składzie chemicznym oraz własnościach fizycznych, które nadawałyby się do realizowanych metod otrzymywania metali. W zależności od chemizmu procesu rozróżnia się następujące typy prażenia: 1. Prażenie kalcynujące stosowane jest najczęściej do przerobu materiałów węglanowych i realizowane jest w takich temperaturach, ażeby zaszła dysocjacja węglanów zgodnie z reakcją MCO3 = MO + CO2 Stała równowagi tej reakcji, przy założeniu, że 3 MCO a = 1 i MO a = 1, wynosi 2 CO p p K = . Jest to równocześnie proces wzbogacania surowców, ponieważ wskutek eliminacji z prażonego materiału CO2, wzrasta procentowa zawartość metalu w produktach. Reakcje dysocjacji węglanów zachodzą również w czasie prażenia utleniającego koncentratów siarczkowych i z tego względu zostaną one szerzej omówione. Dowolny stan układu można określić za pomocą temperatury i ciśnienia. W stanie równowagi tylko jedna z tych wartości jest zmienną niezależną, druga natomiast jest jej funkcją. Przy zmianie jednej ze zmiennych liczba faz pozostaje stała, zmieniają się natomiast stosunki wagowe. Za zmienną niezależną przyjmuje się zwykle temperaturę. Ponieważ dysocjacji towarzyszy zwykle pochłanianie ciepła, dlatego też podwyższenie temperatury powinno prowadzić do przesunięcia równowagi w kierunku zwiększenia wartości 2 CO p . Dla danego węglanu, w oparciu o rozważania termodynamiczne, można obliczyć wartości 2 CO p w funkcji temperatury, korzystając z zależności o T o T o T S T H G ∆ − ∆ = ∆ p o T K T R G ln − = ∆ , którą przedstawiono na rys. 4.1. Rys. 4.1. Zależność 2 CO p od temperatury. Temperatura, przy której prężność CO2 osiąga wartość 1 atm nosi nazwę temperatury inwersji. Zależność 2 CO p od T rozdziela powierzchnię wykresu na dwa obszary I i II. Pierwszy z tych obszarów, położony nad krzywą można uważać za miejsce geometryczne punktów, dla których słuszna jest nierówność
... zobacz całą notatkę






Komentarze użytkowników (0)