To tylko jedna z 3 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


Nr ćwiczenia:
I
Temat: Pomiar prężności pary.
Grupa
34
Data wyk
30.11.99.
Katarzyna Augustyn
Arkadiusz Kmiec
Agnieszka Przytocka
Zespół:
6
WSTĘP
Cząsteczki w powierzchniowej warstwie lustra cieczy obdarzone wystarczającą do pokonania sił oddzialywan międzycząsteczkowych energią, mogą opuścić ciecz przechodząc do wolnej przestrzeni nad powstałą fazą gazową, wypełniającą pozostałą część zamkniętego naczynia.
Intensywność procesu wzrasta ze wzrostem temperatury. W miarę wzrostu stężenia cząstek w fazie gazowej obserwuje się w coraz większym stopniu proces odwrotny tj. przechodzenie pewnej ich liczby do fazy ciekłej. Jest to proces skraplania. W miarę upływu czasu szybkość pierwszego procesu maleje a drugiego wzrasta. Gdy szybkość par jest równa szybkości skraplania ustali się stan równowagi dynamicznej. Równowagę tę charakteryzuje właściwa dla danej cieczy prężność pary nasyconej odpowiadająca danej temperaturze. Prężność pary nasyconej nie zależy od ilości substancji znajdującej się w poszczególnych fazach, ani też od zajmowanej przez nią objętości. Jest ona głównie funkcją temperatury.Prężność stanowi miarę stężenia substancji w fazie gazowej. Wskótek ponownego ogrzania i wzrostu temperatury zamkniętego układu naruszony zostaje w nim ten stan równowagi, rośnie energia cząsteczek, rośnie szybkość parowania, maleje szybkość skraplania, rośnie prężność par nad roztworem. W wyniku tego ponownie ustali się stan równowagi na innym poziomie dla każdej temperatury. Każdej z temperatur odpowiada właściwa dla niej prężność pary nasyconej, a krzywa parowania p=f(T) określa równowagę między cieczą a parą.
Opis ćwiczenia
Celem ćwiczenia jest obliczenie entalpii parowania heptanu poprzez pomiar prężności pary w temperaturach 35, 45, 55, 65°C izoteniskopową.
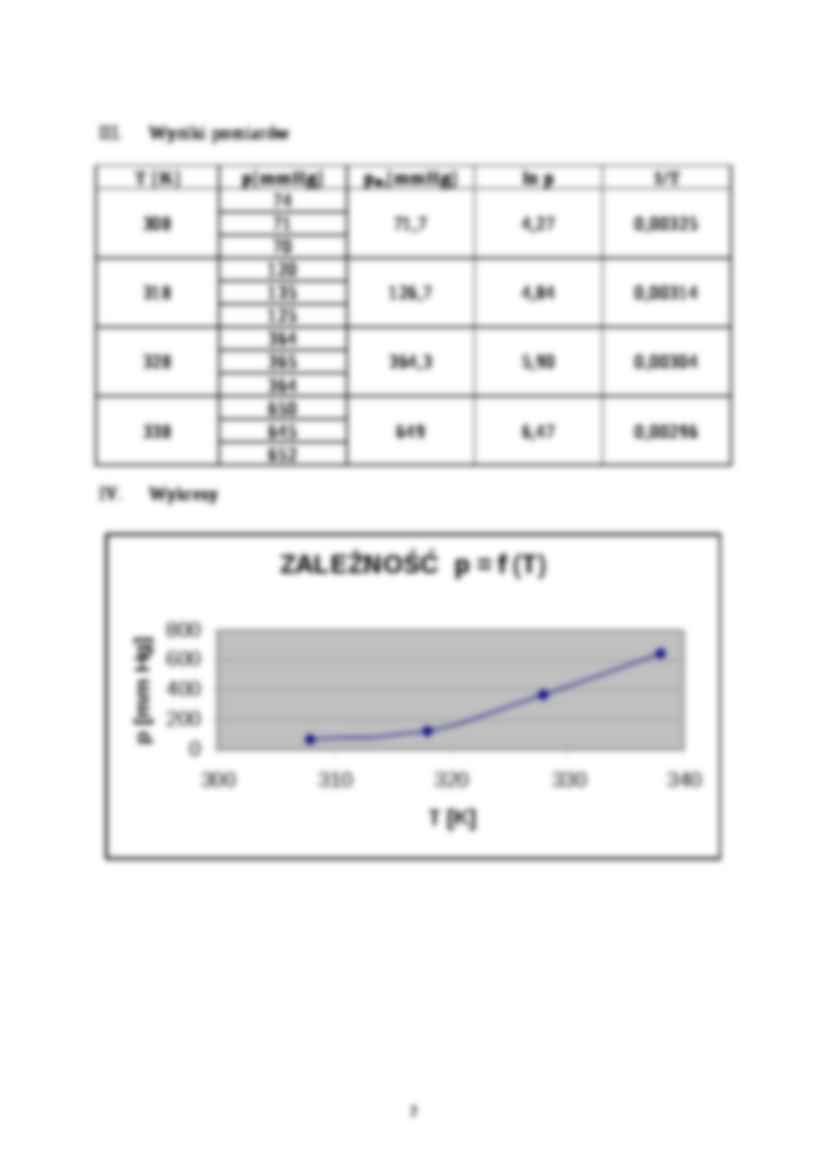
Wyniki pomiarów
T [K]
p[mmHg]
pśr.[mmHg]
ln p
1/T
74
308
71
71,7
4,27
0,00325
70
120
318
135
126,7
4,84
0,00314
... zobacz całą notatkę






Komentarze użytkowników (0)