
Fragment notatki:
Metalurgia – Leszek Rycerz
113 A3 13-15 pon wt
Pytania dotyczące reakcji metali z wodą kwasami zasadami
Przykładowe procesy metalurgiczne ( pirogeniczne- proces wielkopiecowy, tworzenie żużla),
szereg aktywności metali)
Metalurgia- nauka o materiałach i technologie dotyczące metali, oraz dalszej jej przeróbki,
metaloznawstwo; (przeróbka plastyczna, odlewnictwo, metaloznawstwo, metalurgia
ekstrakcyjna), przeróbka rud metali aż do produktu końcowego
Metalurgia ekstrakcyjna-zajmuje się procesami otrzymywania czystych metali lub ich stopów
rafinacja metali
Właściwe otrzymywanie metali
pirogeniczne- wysokotermiczne, hydrotermiczne w wodzie)
Produkcja stopów
Odlewnictwo
Obróbka powierzchniowa
Lantanowce- pierwiastki ziem rzadkich
Metaloidy – w zależności od sytuacji będą wykazywać właściwości metali lub niemetali
Charakter metaliczny rośnie w dół grupy i w lewą stronę( w obrębie grupy, okresu)
Wł. Atomowe
Wł. Fizyczna
Wł Chemiczne
Metale
mało elektronów
walencyjnych
Większe promienie atomowe
Niższa energia jonizacji
Niższa elektroujemność
Stałe w temp. pokojowe
Dobre przewodnictwo
cieplne i elektryczne
Kowalne i ciągliwe
Oddając elektrony staja się
kationami, reagują z
niemetalami tworząc związki
jonowe
mieszane z innymi metalami
tworzą stopy
Niemetale
Więcej elektronów
Mniejsze promienie atomowe
Większa en. Jonizacji
Większa elektroujemność
3 st. skupienia
Słabe
Nieciągliwe i niekowalne
Przyjmują elektrony stają się
anionami, reagują z metalami
tworząc związki jonowe
Reagują z innymi
niemetalami tworząc związki
kowalencyjne
Litowce- reagują z wodą z wydzielaniem wodoru, litowiec o największym promieniu
atomowym jest najbardziej reaktywny, reaktywność maleje wraz ze zmniejszeniem się
promienia atomowego. Rubid i Cez eksplodują przy kontakcie z wodą.
Roztwarzalność berylowców w wodzie: (Beryl nie roztwarza się) :
Me+2H2O = Me2+ + 2OH-+ H2 (Mg- reaguje na gorąco, a pozostałe – na zimno)
1)Wodór może być wydzielany z roztworem przez metale o ujemnym potencjale a więc
metale nieszlachetne. (podobnie roztwarza się cynk lub chrom)
Fe+2H+= Fe2++H2
Natomiast nie zajdzie reakcja roztwarzania miedzi w kwasie solnym, podobnie zachowuje się
srebro)
Cu+2H+=Cu2++H2
Nieszlachetne- wypierają wodór
Szlachetnie- nie wypiorą wodoru
2) Metale szlachetne roztwarzają się natomiast w roztworach wodnych silnych utleniaczy
(kwasy utleniające HNO3, st. gorący H2SO4)
Cu+H++NO3-=Cu2++NO+ H2O
3) Złoto platyna i pallad nie roztwarzają się w kwasie azotowym oraz gorącym st. siarkowym;
potrafi je natomiast roztworzyć woda królewska(mieszanina stężonych kwasów:
solnego(HCl) i azotowego (HNO3) w stosunku objętościowym 3:1)
HCl+HNO3=H++NO3-+Cl3Pt+16H++4HNO3- +18Cl-=3PtCl62-+4NO+8H2O
Au+4H++NO3-+4Cl- = AuCl4-+NO+2H2O
4)Reakcje metali z wodorotlenkami
Cynk, cyna, glin roztwarzają się w wodorotlenkach z wydzielaniem wodoru, gdyż są to
metale amfoteryczne. Amfoteryczne pierwiastki związki kompleksowe
Zn+2OH-+2H2O =[Zn(OH)4]2- + H2
Sn +2OH-+4H2O =Sn(OH)62- + 2H2
Al +OH-+3H2O =Al(OH)4- + 3/2H2
Amfoteryczne pierwiastki związki kompleksowe
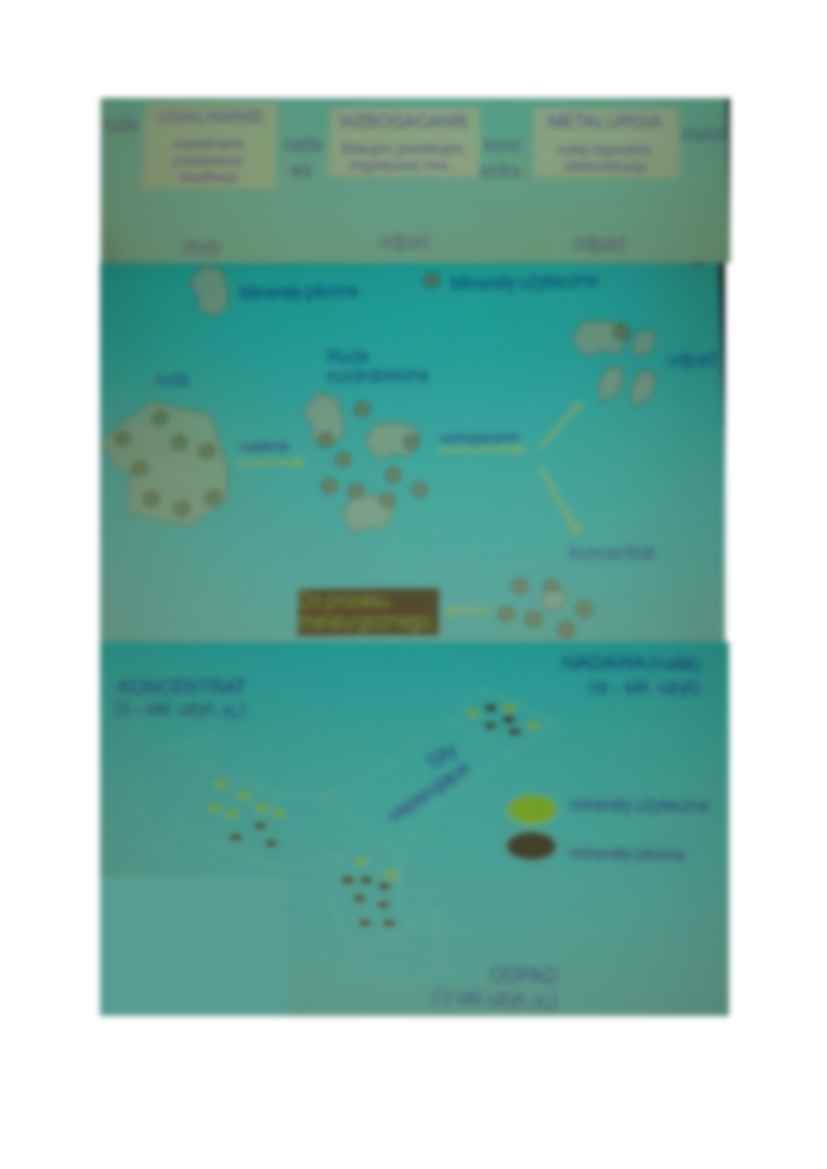
Metalurgia ekstrakcyjna- dział metalurgi zajmujący się otrzymywaniem
Minerulgia- separacja bez zmiany składu chemicznego
Metalurgia- separacja z zmianą chemiczna
RUDY (uwalnianie, rozdrabnianie, przesiewanie, klasyfikacja) NADAWA (zmieniona
ruda) ( wzbogacanie, flotacyjne, grawitacyjne, magnetyczne) KONCENTRACJA (
metalurgia, wykop, ługowanie, elektrorafinacja) METAL
Metody wzbogacania wykorzystują różnice we właściwościach fizycznych składników rudy
(minerałów użytecznych i płonnych)
Cel wzbogacania:
Wydzielanie minerałów użytecznych w postaci koncentratu lub półproduktu
Separacja niepożądanych zanieczyszczeń i składników płonnych(opad)
Wyprodukowanie koncentratu metalu (wysoki uzysk wysoka jakość koncentratu)
rozdzielanie dwu lub kilku minerałów użytecznych (koncentraty różnych metali)
Właściwości
Wygląd
Gęstość
Podatność
magnetyczna
Przewodnictwo
elektryczne
Właściwości
powierzchniowe
Sposób wykorzystania
Cząstki (duże kawałki) o
wyraźnie odmiennej barwie,
strukturze, połysku, itp… są
oddzielone od reszty
materiału
1.Cząstki o wysokiej gęstości
toną w cieczach ciężkich,
lekkie pozostają na
powierzchni
2. Złoże cząstek o różnej
gęstości uległa podziałowi
(cząstki ciężkie tworzą dolną
warstwę)
3. Ciężkie i lekkie cząstki
poruszają się wzdłuż różnych
dróg w przepływającej
warstwie wody
W polu magnetycznym
cząstki magnetyczne
poruszają się wzdłuż różnych
dróg w porównaniu z
cząstkami niemagnetycznymi
Cząstki o różnym
przewodnictwie ulegają
naładowaniu o różnym
stopniu i będą różnie
poruszać się w polu
elektrycznym
Cząstki hydrofobowe ulegają
wyniesienu do piany
(koncentrat), cząstki
hydrofilowe opadają na dno
(opad)
Proces rozdziału
Sortowanie ręczne
Separacja w cieczach
ciężkich
Koncentracja grawitacyjna
Koncentracja grawitacyjna
Separacja magnetyczna
Separacja elektrostatyczna
Flotacja pionowa
KONCENTRAT- procesy chemiczne
Pirometalurgia
o Bardzo stara metoda
o Bezkonkurencyjna do rud o wysokiej zawartości minerału użytecznego,
prowadzona w duzej skali
o Wysoka temp, duża szybkość reakcji
o Problemy skażenie środowiska, wysokie zużycie energii, wysokie zapylenie
Hydrometalurgia
o Zazwyczaj stosowana do rud o niższej zawartości i skomplikowanej budowie,
stosowana w mniejszej skali
o Niższa temperatura, niższa szybkość reakcji
o Pierwszy proces hydrometalurgiczny: przeróbka boksytów na początku 20
wieku
Przeróbka rud o wysokiej
zawartości
Ubogie rudy
Rudy siarczkowe
Rozdział podobnych metali
(np. Ni i Co)
Produkty zanieczyszczające
środowisko
skala
Szybkość reakcji
nieekonomiczna
Ekonomiczna
Możliwa( selektywne
ługowanie
Brak wmisji SO2, S0 lub So4
produkowane
Możliwe ( różne metody)
nieopłacalne
Woda odpadowa, stałe i
ciekłe odpady
Mniejsza skała, możliwość
jej rozszerzenia
Niższa niż piro
Gazy, pyły
Metalurgia chemiczna
Hydrometalurgia
- ługowanie
-ekstrakcja rozpuszczalnika
-wytrącanie
- szuszenie
Pirometalurgia
-wytapianie
Elektrometalurgia
-elektroliza
Emisja So2( może być
przerobiony w H2SO4)
Niemożliwy
Nieekonomiczna , w małej
skali
Duża
Wstępna obróbka termiczna
- prażenie utleniające- stosuje się do konwersji trudno rozpuszczalnych siarczków metali do
postaci łatwo rozpuszczalnej
ZnS + 1,5 O2 = ( 650st.) ZnO +SO2
-prażenie niesiarczające stosuje sie celem przeprowadzenia minerału ( metal, tlenek) w łątwo
rozpuszczalne siarczany; prażenie SnO2, SnO, Sn ze stężonym H2SO4 w temp. 4000C
SnO2+H2SO4---4000C---Sn(SO4)2+ 2H2O
Pirometalurgia żelaza
- ruda żelaza zawiera minerały tego metalu Fe2O3- hematyt, Fe3O4- magnetyt; ponadto jako
złoże występuje głównie krzemionka (SiO2)
-Otrzymywanie żelaza z jego rud polega na reprodukcji tlenków żelaza za pomocą węgla
i tlenku węgla, który jest szczególnie czynnym reduktorem, ponieważ jako gaz reaguje z
tlenkami żelaza w całej objętości pieca. Szybkość redukcji wzrasta ze wzrostem temperatury,
a wydzielanie produktów reakcji w stanie ciekłym sprzyja usuwaniu zanieczyszczeń, dlatego
proces przeprowadza się w wysokich temperaturach w tak zwanych wielkich piecach. Są to
wielkie konstrukcje mające do 30 m wysokości i 2000 m3 pojemności.
- ładowanie pieca odbywa się od góry przez urządzenia zasypowe, przez które wprowadza
się: koks, rudę i topniki (dolomit, wapień), które ze złożem rudy tworzą w piecu łatwo
topliwą mieszaninę krzemianów wapnia, glinu, manganu zwaną żużlem. Koks wprowadzony
do wielkiego pieca spala się w strumieniu gorącego powietrza wdmuchiwanego przez dysze.
Wytworzony CO2 przechodząc przez rozżarzone warstwy koksu redukuje się do tlenku węgla
-gorące gazy (CO i CO2) unosząc się ku górze ogrzewając wsad wielkopiecowy zsuwają się
ku dołowi. Procesy zachodzące w warstwach rudy zależą od temperatury wytworzonej w
dolnej strefie pieca. W najwyższych jego częściach następuje odwodnienie rury, przy
temperaturze 120-2300C. Redukcja rozpoczyna się w temperaturze 4200C i początkowo
polega na redukcji Fe(III) do Fe(II). W miarę posuwania się ku dołowi i dalszego wzrostu
temperatury następuje redukcja tlenków do metalu. W temp. 9300C redukująco działa również
węgiel. W miarę obsuwania się ładunku do dolnych, gorętszych części pieca, mających temp.
Większą niż 9300C, następuje stopienie żelaza i na skutek rozpuszczenia się w nim węgla i
innych pierwiastków powstaje stop żelaza z węglem (2,5-4,5%) oraz krzemem, fosforem,
manganem. Jest to surówka- produkt wielkiego pieca.
Proces wielkopiecowy- proces prowadzony w wielkim piecu i obejmujący: doprowadzenie
surowców (rud żelaza, koksu, topników) przez górną częśc pieca, wdmuchiwanie (od dołu)
gorącego powietrza i gazów spalinowych, redukcję tlenków żelaza do metalu, oddzielanie
skały płonej, spust surówki i żużla, odprowadzanie gazów wielkopiecowych.
Gaz wielkopiecowy-produkt uboczny w procesie wielkopiecowym. Skład zależy od wsadu
wielkopiecowego i zawarty jest w granicach 10-16% - CO2, 23-30% - CO; 0,3-4% - CH4;
52- 60% N2. Na 1tonę surówki wydziela się do 4000m3 gazu wielkopiecowego. Gaz
wielkopiecowy nie oczyszczony zawiera znaczna ilość pyłu. Wartość opałowa 33503700kJ/m 3. Stosowany do opalania nagrzewnic wielkopiecowych oraz baterii
koksowniczych.
Równocześnie z redukcją tlenków żelaza odbywa się też reakcja pomiędzy topnikami i
zanieczyszczeniami rudy. W wyniku tych reakcji tworzy się ciekły żużel, który spływa w dół
pieca i jako lżejszy od surówki tworzy warstwę na jej powierzchni.
W dolnej części pieca zachodzą reakcje utleniania węgla, które prowadzą do powstania CO
C+O2=CO2
CO2 +C =2 CO
Tlenek ten łatwo reaguje ze stopioną, w wysokiej temperaturze pod wpływem topników rudą
żelaza. Zachodzą następujące reakcje:
3Fe2O3 CO 2 Fe3O4 CO2
Fe3O4 CO 3FeO CO2
FeO CO Fe CO2
Jest to tzw. Redukcja częsciowa, redukcja właściwa, czyli redukcja węglem zachodzi w
dolnej strefie wielkiego pieca, w której panuje najwyższa temperatura, dochodząca do ok.
1200-15000C.
Wszystkie reakcje zachodzące w piecu:
CaCO3 T 800900C CaO CO2
MgCO3 T 800900C MgO CO2
CaO SiO 2 T 1200C CaSiO 3( c )
6CaO P4 O10 T 1200C 2Ca 3 ( PO 4 ) 2 ( c )
CO2 C 400 2CO
950C
3Fe 2 O3 CO 2 Fe3 O4 CO2
Fe3 O4 CO 3FeO CO2
FeO CO Fe CO2
FeO C Fe CO
C H 2 O CO H 2
Tworzenie gazowych reduktorów
C+H2O= CO + H2 600 *c
C+CO2= 2 CO ( 1700
2C+O2= 2 CO( 1700
Redukcja tlenków żelaza
3 CO+ Fe2O3= 2Fe + 3 CO2 ( 900
3H2 + Fe2O3= 2Fe + 3H20 ( 900
Konwertorownie- proces oczyszczania zanieczyszczeń
Surówka zawiera ok. 4 % C;
Stal zawiera 0,1-1,2 % węgla ( większość stali zawiera mniej niż 0,5% C)
Usunięcie węgla- przedmuchiwanie tlenu przez stopioną surówkę
2Fe+ O2 FeO
FeO + C Fe + CO
Produkcja cynku
1.prazenie utleniające
2.pirogenicza
- roztwarzenie w kwasie siarkowym
Hydrometalurgia jest metoda selektywnego wydzielania metali rud za pomocą procesów
zachodzących w roztworach wodnych; Najważniejszym procesem jest ługowanie:
Ługowanie roztworem H2SO4 w obecności tlenu
Cu2S + O2+ 4H+=2Cu2+ +S + 2H2O
Ługowanie roztworami cyjanków w obecności tlenu
4Au+8CN+ +O2+ 2H2O= 4Au(CN)2-+ 4OHŁugowanie alkaliczne boksytów
AlOOH +OH- + H2O = [Al.(OH)4]-
Pozostałe etapy procesów hydrometalurgicznych
-selektywne koncentrowanie: ekstrakcja, procesy membranowe, wymiana jonowa, flotacja
jonowa,
- wydzielenie metalu(metali): elektroliza, cementacja, redukcja ciśnieniowa wodorem,
-elektroliza Cu2+ +2e= Cu
-cementacja Cu2+ +Fe = Fe2+ +Cu
-redukcja wodorem Cu2+ + H2 = Cu + 2H+
... zobacz całą notatkę

Komentarze użytkowników (0)