Skład zespołu:
Karolina Zieleniewska
Joanna Woroszył
Data wykonania ćwiczenia: 04.04.2013 r.
Prowadzący: dr inż. Marek Dąbrowski
Równowaga ciecz-para w układzie jednoskładnikowym
Cel ćwiczenia
Celem ćwiczenia był pomiar temperatur wrzenia cieczy w układzie jednoskładnikowym przy różnych ciśnieniach, wyznaczenie entalpii parowania, normlanej temperatury wrzenia i entropii parowania w normlanej temperaturze wrzenia oraz sprawdzenie jej zgodności z regułą Troutona.
Badana ciecz: 1-propanol
Wykonanie ćwiczenia
Do pomiarów użyto ebuliometr Świętosławskiego. Układ podczas pomiaru utrzymywany był w stanie wrzenia. Metoda ta polega na pomiarze temperatury wrzenia cieczy przy ustalonym i znanym ciśnieniu zewnętrznym.
Przez chłodnicę ebuliometru wlano 1-propanol tak, że jego objętość nie przekraczała 40% objętości zbiorniczka ebuliometru.
Włączono dopływ wody chłodzącej
Włączono prąd grzania o wartości natężenia 0,8 A.
Dokonano pomiaru ciśnienia atmosferycznego za pomocą barometru.
Wyniosło ono: 752,0 Tr
Po ustabilizowaniu się temperatury odczytano temperaturę wrzenia substancji
T= 367,95K
Zwiększano i zmniejszano natężenie prądu o 1 A i notowano temperatury wrzenia substancji przy zadanym natężeniu prądu w celu określenia zakresu prądu, w którym wskazania termometru będą niezmienne - tzw. obszar niezmienności temperatur (obszar „plateau”).
Włączono pompę próżniową.
Za pomocą kranu manostatu, zmniejszano kolejno ciśnienie aż do uzyskania wartości ciśnienia p=264,0 Tr. Dla każdej wartości ciśnienia zmierzono temperaturę wrzenia.
Po zakończeniu pomiarów wyłączono grzanie ebuliometru, zapowietrzono układ, a po kilku minutach wyłączono pompkę wodną i odcięto dopływ wody chłodzącej.
Ebuliometr opróżniono zlewając badaną ciecz do zlewki.
Opracowanie wyników
Wyznaczenie obszaru stałości temperatury (obszaru „plateau”)
Tabela 1. Zależność temperatury wrzenia 1-propanolu od natężenia prądu grzania.
Natężenie prądu/A
Temperatura wrzenia/K
0,4
362,35
0,5
363,85
0,6
367,65
0,7
367,65
0,8
367,95
0,9
367,95
1,0
367,95
1,1
367,95
1,2
367,95
1,3
367,95
1,4
368,05
Optymalna wartość natężenia prądu dla której prowadzono pomiary prężności pary w funkcji temperatury wrzenia wyniosła
(…)
…
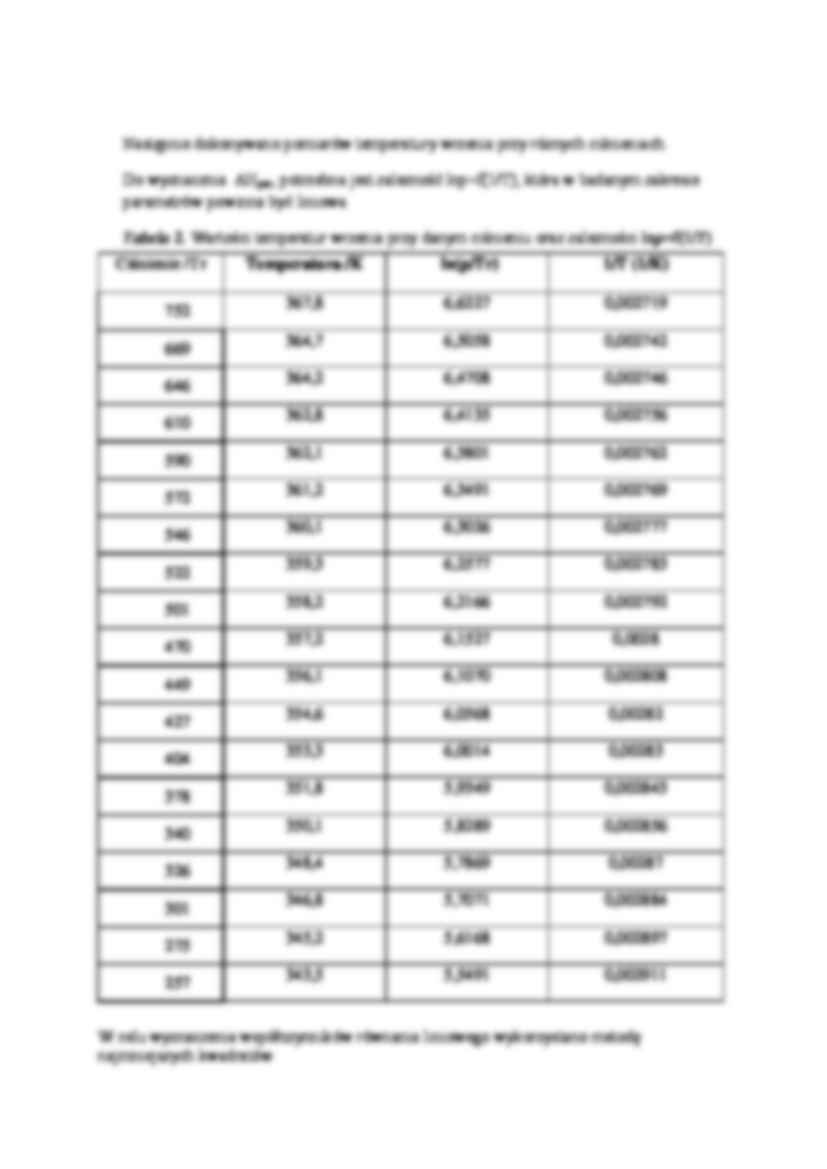
353,3
6,0014
0,00283
378
351,8
5,9349
0,002843
340
350,1
5,8289
0,002856
326
348,4
5,7869
0,00287
301
346,8
5,7071
0,002884
275
345,2
5,6168
0,002897
257
343,5
5,5491
0,002911
W celu wyznaczenia współczynników równania liniowego wykorzystano metodę najmniejszych kwadratów.
Wykres 1. Zależność logarytmu naturalnego z prężności pary nasyconej w funkcji odwrotności temperatury wrzenia 1-propanolu.
Sprowadzenie równania Clausiusa-Clapeyrona do postaci liniowej:
Z regresji liniowej otrzymano:
a = -5615,32K
Sa=41,61K
b = 21,89
Sb=0,12
Ostatecznie:
a=(-5615 ± 42)
b=(22 ± 0,1) K
Równanie prostej:
-5616= - ΔHpar/R, zatem
ΔHpar = 5616* 8,314 = 46691,42 ΔHpar = = 46,7 Niepewność entalpii parowania:
Wyznaczona wielkość temperatury wrzenia pod normalnym ciśnieniem:
Tw = 365,5 K
Obliczanie entropi parowania:
Wnioski
Otrzymana zależność jest prostoliniowa, jednak wartości obliczone różnią się od stablicowanych. Różnice mogą być spowodowane niedokładnymi odczytami.
Wyznaczona entropia parowania 1-propanolu nie spełnia reguły Troutona. Wywołane jest to asocjacją badanego związku, który tworzy wiązania wodorowe między cząsteczkami. Oddziaływania te znacząco wpływają na swobodę ruchu cząsteczek w ciekłym stanie skupienia. Po przejściu w fazę gazową 1-propanol, nie tworzy wiązań wodorowych i właśnie z tego wynika tak duża wartość entropii parowania.
…
... zobacz całą notatkę





Komentarze użytkowników (0)