To tylko jedna z 25 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


W. Bunsena, typy reakcji red-ox, wartościowość a stopień utlenienia, reakcje utleniacz-reduktor w środowisku kwaśnym, reakcje utleniacz-reduktor w środowisku zasadowym, reakcje utleniacz-reduktor w środowisku obojętnym, reakcje dysproporcjonowania, wpływ środowiska kwasowo-zasadowego na przebieg reakcji chemicznej, mneralizacja bifenylu metodą Kjeldahla, mineralizacja bifenylu metodą Lassaigne’a, mineralizacja organicznych związków azotu metodą Lassaigne’a, delokalizacja elektronów w cząsteczce.
...Typy reakcji red-ox:
1. Przebiegające w środowisku kwaśnym
2. Przebiegające w środowisku zasadowym
3. Przebiegające w środowisku obojętnym
4. Obojnaczość właściwości red-ox
5. Dysproporcjonowania
6. Utleniania substancji, w których reduktorem
są atomy na różnych stopniach utlenienia....
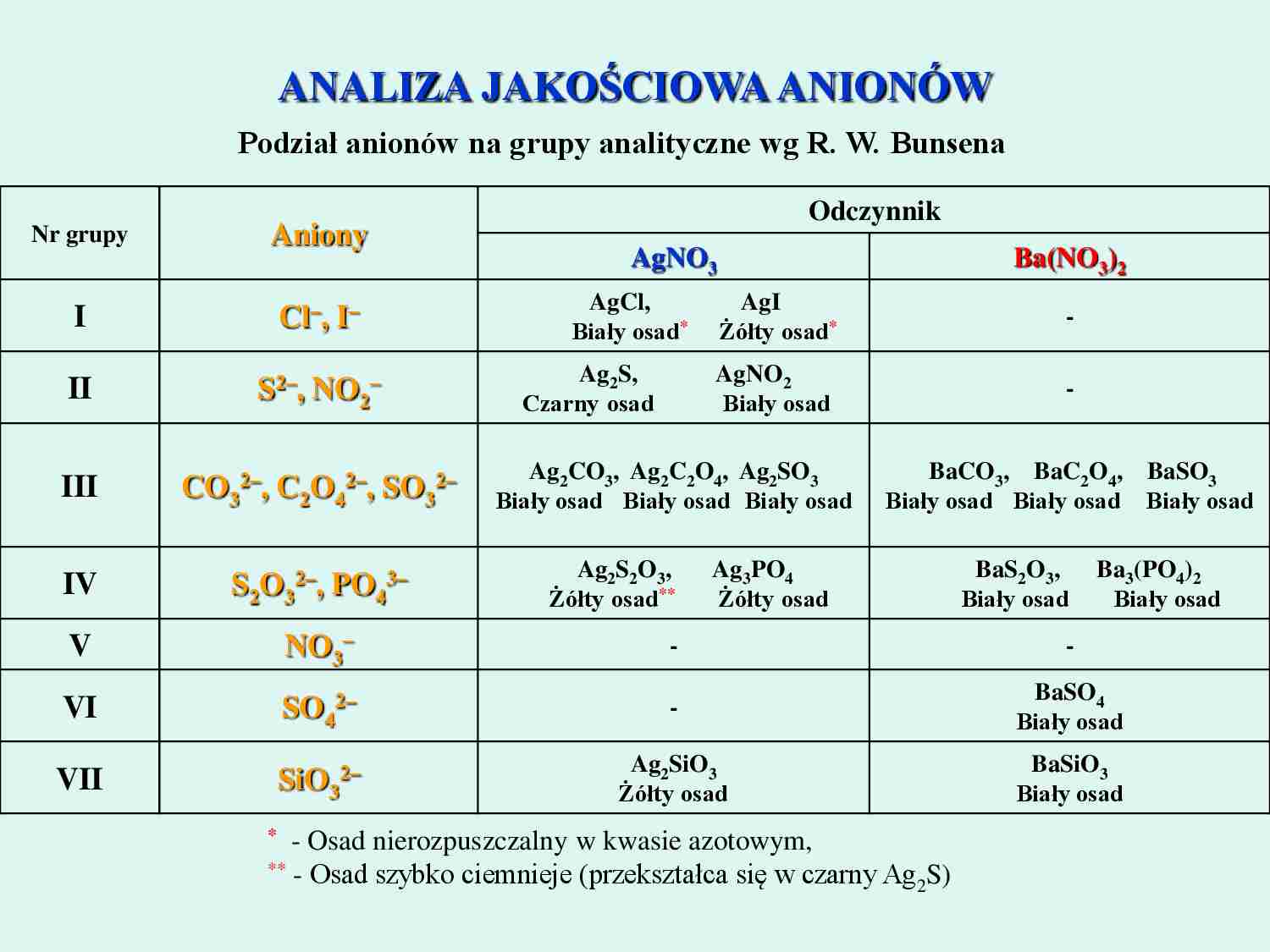
ANALIZA JAKOŚCIOWA ANIONÓWPodział anionów na grupy analityczne wg R. W. BunsenaOdczynnik Nr grupyAnionyAgNOBa(NO )33 2ICl–, I–AgCl, AgIBiały osad-*Żółty osad*S, AgNOIIS2–, NO –Ag222Czarny osad Biały osad-CO , Ag C O , Ag SOBaCO , BaC O , BaSOIIICO 2–, C O 2–, SO 2–Ag232242332433243Biały osad Biały osad Biały osadBiały osad Biały osad Biały osadS O , Ag POBaS O , Ba (PO )IVS O 2–, PO 3–Ag2 2 3342334 2234Żółty osad**Żółty osadBiały osad Biały osad VNO –--3BaSOVISO 2–-44Biały osadSiOBaSiOVIISiO 2–Ag2333Żółty osadBiały osad* - Osad nierozpuszczalny w kwasie azotowym, ** - Osad szybko ciemnieje (przekształca się w czarny Ag S)
2REAKCJE CHEMICZNEREAKCJE KWAS - ZASADAREAKCJE UTLENIACZ - REDUKTOR1. SYNTEZY1. SYNTEZY2. ANALIZY2. ANALIZY3. WYMIANY3. WYMIANYTypy reakcji red-ox:1. Przebiegające w środowisku kwaśnym2. Przebiegające w środowisku zasadowym3. Przebiegające w środowisku obojętnym4. Obojnaczość właściwości red-ox5. Dysproporcjonowania6. Utleniania substancji, w których reduktoremsą atomy na różnych stopniach utlenienia-IIO
I
IHHWARTOŚCIOWOŚĆ A STOPIEŃ UTLENIENIAWARTOŚCIOWOŚĆ jest to liczba wiązań chemicznychjaką tworzy atom pierwiastka w cząsteczce związku chemicznegoSTOPIEŃ UTLENIENIA jest liczba elektronówjaką atom przyjmuje lub oddaje tworząc wiązania chemiczne
0
0
-I
II
-IOOH Ca H
0
-IIO
0
0
0 0
I -IOOO
IH - H H - Cl
IHHO 0
IH-XIVXIIVI-II
I
-III
ICr O 2–HNH2 7
IH
-IIO
I
-III
IHCC
IH
IHREAKCJE UTLENIACZ – REDUKTOR W ŚRODOWISKU KWAŚNYMVII III II IV MnO – + C O 2- + H+ = Mn2+ + CO + H O42422VI-VIII Redukcja-II III 2-UtlenianieC O24VII II UtleniaczMnO – + 5e + 8 H+ = Mn2+ + 4 H O·242III IV 2-ReduktorC O= 2 CO+ 2e·52422 MnO – + 5C O 2- + 16 H+ = 2 Mn2+ + 10 CO + 8 H O42422REAKCJE UTLENIACZ – REDUKTOR: SYNTEZAUtleniaczReduktor00-IIIIH + N= NH223REAKCJE UTLENIACZ – REDUKTOR: ANALIZAUtleniaczII -II Reduktor I 0 4HgO 2 Hg O + O22REAKCJE UTLENIACZ – REDUKTOR: WYMIANAReduktorUtleniaczVII III II V MnO – + NO – + H+ = Mn2+ + NO – + H O4232Reakcja redukcji: MnO – + 5e + 8 H+ = Mn2+ + 4 H O42* 2 Reakcja utlenienia: NO – + H O = NO –+ 2 H+ + 2e223* 5 2 MnO – + 5 NO – + 6 H+ = 2 Mn2+ + 5 NO – + 3 H O4232REAKCJE UTLENIACZ – REDUKTOR:Przebiegające w środowisku zasadowym0II-IIIZn + NO – + OH– = [Zn(OH) ]2– + NH343Utleniacz
(…)
…
I
-I -I
-I
+ 10 H2O = 6 CO2 + 20 e + 18 H+ + 2 NH4+ ·3
I -I
III
NO 2
Cr2O72- + 6 e + 14 H+ = 2 Cr3+ + 7 H2O ·10
-III
NH 2
I
-I -I
3 + 10 Cr2O72- + 86 H+ = 20 Cr3+ + 6 NH4+ + 18 CO2 + 40 H2O
-I -I
I
III
NO 2
O O
REAKCJE UTLENIACZ – REDUKTOR: V
S
O 0
Reakcje wykorzystywane jako reakcje charakterystyczne S
w analizie anionów KATENACJA 0
S O
V
I grupa anionów: 2 MnO4– + 10 Cl– + 16 H+ = 2 Mn2+ + 5 Cl2 + 8 H2O S…
... zobacz całą notatkę






Komentarze użytkowników (0)