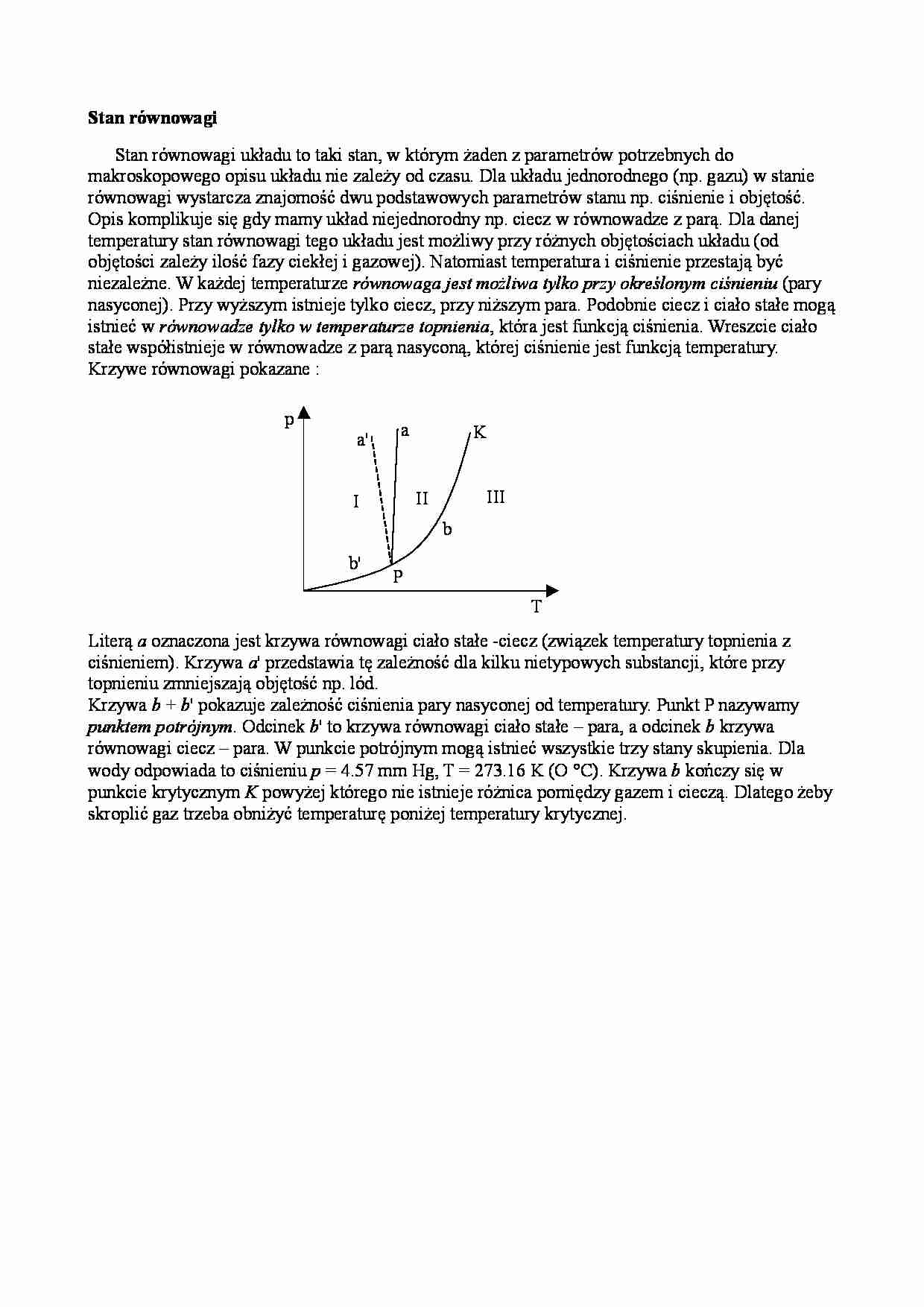
Stan równowagi Stan równowagi układu to taki stan, w którym żaden z parametrów potrzebnych do makroskopowego opisu układu nie zależy od czasu. Dla układu jednorodnego (np. gazu) w stanie równowagi wystarcza znajomość dwu podstawowych parametrów stanu np. ciśnienie i objętość. Opis komplikuje się gdy mamy układ niejednorodny np. ciecz w równowadze z parą. Dla danej temperatury stan równowagi tego układu jest możliwy przy różnych objętościach układu (od objętości zależy ilość fazy ciekłej i gazowej). Natomiast temperatura i ciśnienie przestają być niezależne. W każdej temperaturze równowaga jest możliwa tylko przy określonym ciśnieniu (pary nasyconej). Przy wyższym istnieje tylko ciecz, przy niższym para. Podobnie ciecz i ciało stałe mogą istnieć w równowadze tylko w temperaturze topnienia , która jest funkcją ciśnienia. Wreszcie ciało stałe współistnieje w równowadze z parą nasyconą, której ciśnienie jest funkcją temperatury. Krzywe równowagi pokazane : Literą a oznaczona jest krzywa równowagi ciało stałe -ciecz (związek temperatury topnienia z ciśnieniem). Krzywa a ' przedstawia tę zależność dla kilku nietypowych substancji, które przy topnieniu zmniejszają objętość np. lód. Krzywa b + b ' pokazuje zależność ciśnienia pary nasyconej od temperatury. Punkt P nazywamy punktem potrójnym . Odcinek b ' to krzywa równowagi ciało stałe – para, a odcinek b krzywa równowagi ciecz – para. W punkcie potrójnym mogą istnieć wszystkie trzy stany skupienia. Dla wody odpowiada to ciśnieniu p = 4.57 mm Hg, T = 273.16 K (O °C). Krzywa b kończy się w punkcie krytycznym K powyżej którego nie istnieje różnica pomiędzy gazem i cieczą. Dlatego żeby skroplić gaz trzeba obniżyć temperaturę poniżej temperatury krytycznej. p T a a' b b' K P I II III Document Outline Stan równowagi
... zobacz całą notatkę



Komentarze użytkowników (0)