kod kursu:
Podstawy Chemii Nieorganicznej
CHC012001 l
Sprawozdanie
WYZNACZANIE STAŁEJ DYSOCJACJI
SŁABEGO ELEKTROLITU
Nazwisko
Imię i nazwisko:
prowadzącego kurs:
Nr indeksu:
Ocena
Wyznaczanie stałej dysocjacji słabego kwasu (CH 3COOH)
1. Stężenia roztworów używanych w doświadczeniu
C0CH3OOH = 0,20 mol/dm3
C0CH3OONa = 0,20 mol/dm3
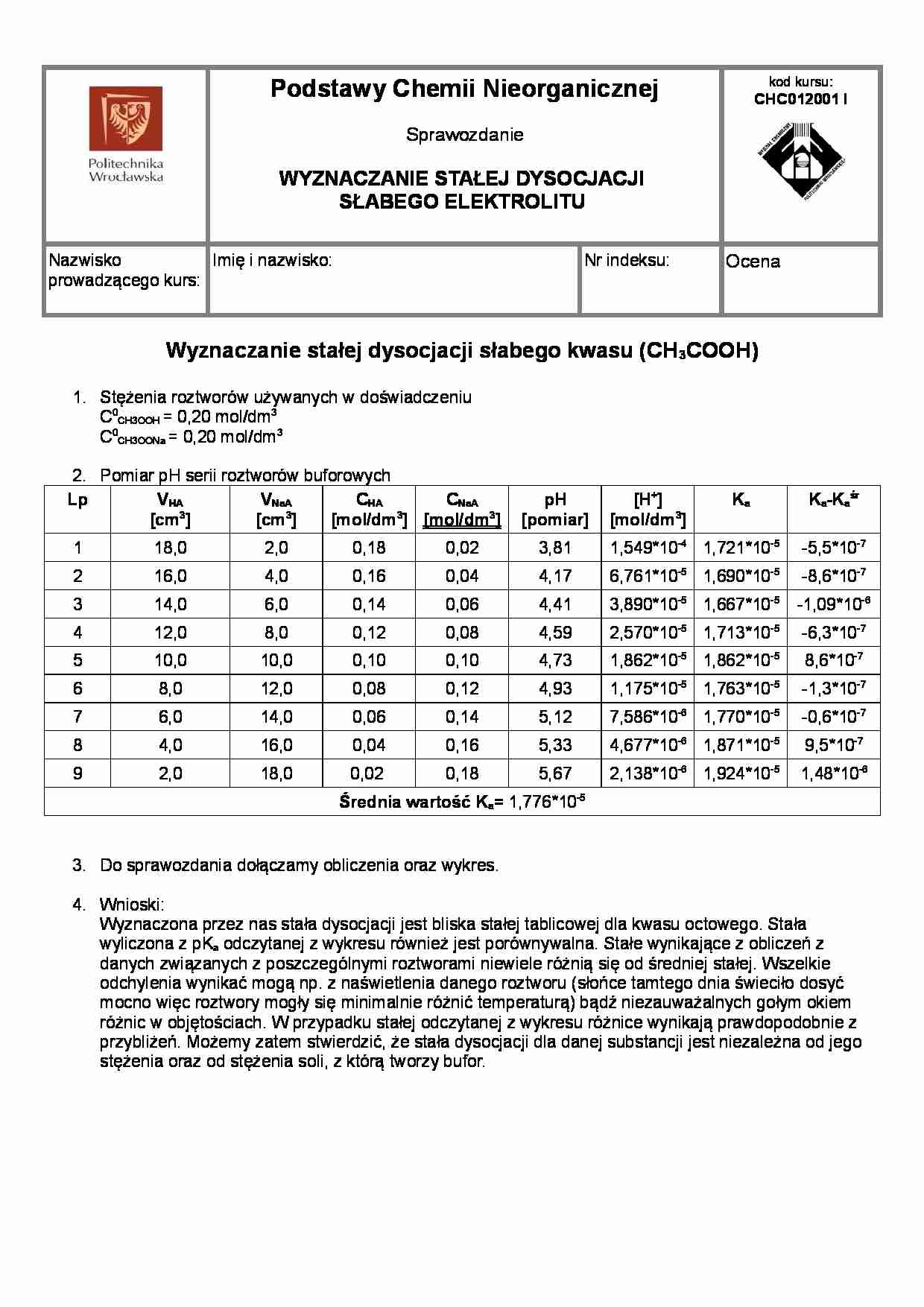
2. Pomiar pH serii roztworów buforowych
Lp
VHA
VNaA
CHA
CNaA
[cm3]
[cm3]
[mol/dm3] [mol/dm3]
pH
[pomiar]
[H+]
[mol/dm3]
Ka
Ka-Kaśr
1
18,0
2,0
0,18
0,02
3,81
1,549*10-4 1,721*10-5
-5,5*10-7
2
16,0
4,0
0,16
0,04
4,17
6,761*10-5 1,690*10-5
-8,6*10-7
3
14,0
6,0
0,14
0,06
4,41
3,890*10-5 1,667*10-5
-1,09*10-6
4
12,0
8,0
0,12
0,08
4,59
2,570*10-5 1,713*10-5
-6,3*10-7
5
10,0
10,0
0,10
0,10
4,73
1,862*10-5 1,862*10-5
8,6*10-7
6
8,0
12,0
0,08
0,12
4,93
1,175*10-5 1,763*10-5
-1,3*10-7
7
6,0
14,0
0,06
0,14
5,12
7,586*10-6 1,770*10-5
-0,6*10-7
8
4,0
16,0
0,04
0,16
5,33
4,677*10-6 1,871*10-5
9,5*10-7
9
2,0
18,0
0,02
0,18
5,67
2,138*10-6 1,924*10-5
1,48*10-6
Średnia wartość Ka= 1,776*10-5
3. Do sprawozdania dołączamy obliczenia oraz wykres.
4. Wnioski:
Wyznaczona przez nas stała dysocjacji jest bliska stałej tablicowej dla kwasu octowego. Stała
wyliczona z pKa odczytanej z wykresu również jest porównywalna. Stałe wynikające z obliczeń z
danych związanych z poszczególnymi roztworami niewiele różnią się od średniej stałej. Wszelkie
odchylenia wynikać mogą np. z naświetlenia danego roztworu (słońce tamtego dnia świeciło dosyć
mocno więc roztwory mogły się minimalnie różnić temperaturą) bądź niezauważalnych gołym okiem
różnic w objętościach. W przypadku stałej odczytanej z wykresu różnice wynikają prawdopodobnie z
przybliżeń. Możemy zatem stwierdzić, że stała dysocjacji dla danej substancji jest niezależna od jego
stężenia oraz od stężenia soli, z którą tworzy bufor.
WYKRES
log([H]*CNaA)
f(x)=0.94*x-4.82
-5.5
-5.7
-5.9
-6.1
-6.3
log(CHA)
-1.8
-1.7
-1.6
pKa odczytana z wykresu: 4,82
zatem
Ka =10-pKa =1,513561 * 10-5 ≈ 1,51 * 10-5
-1.5
-1.4
-1.3
-1.2
-1.1
-1
-0.9
-0.8
-0.7
... zobacz całą notatkę



Komentarze użytkowników (0)