To tylko jedna z 20 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę

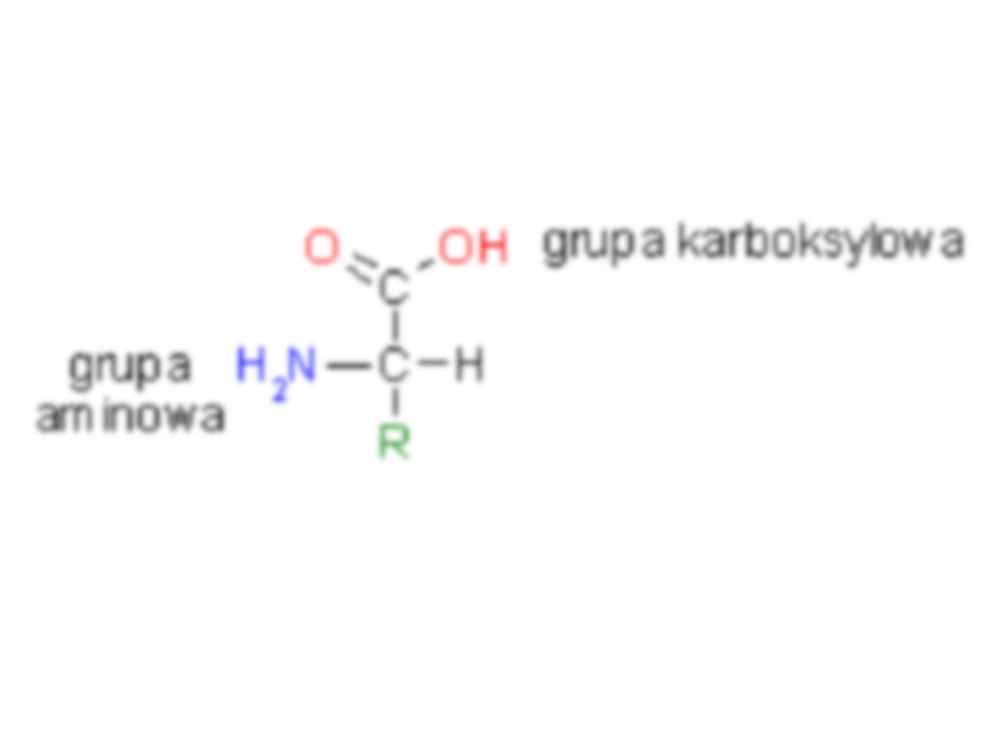
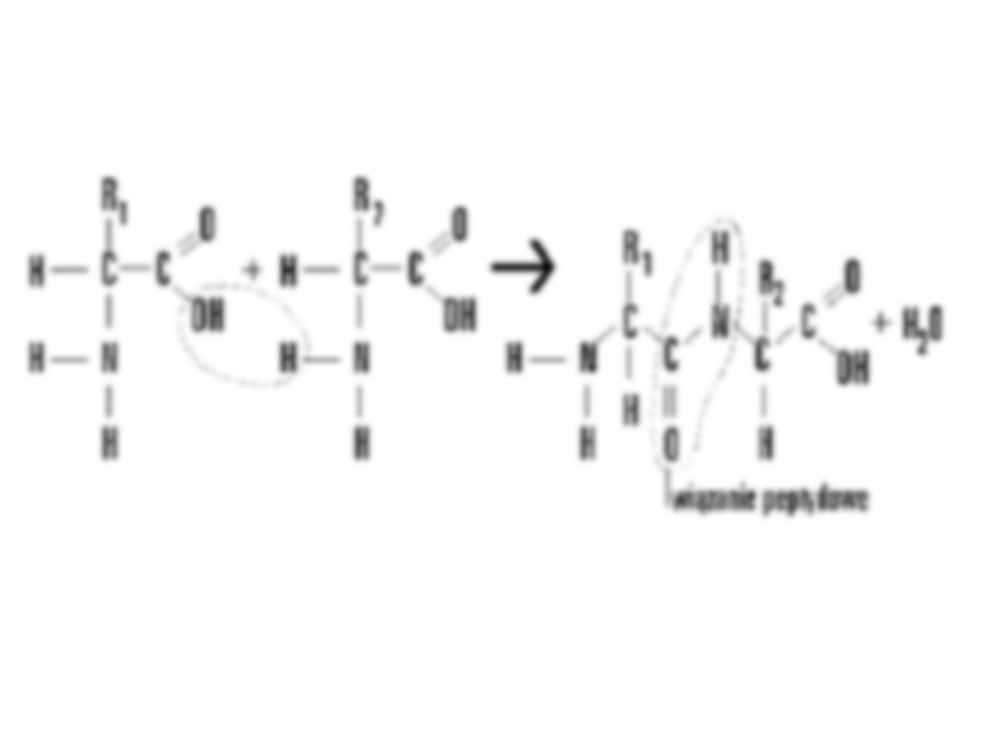
Budowa i funkcje białek Struktura przestrzenna białek, tzw. konformacja Wszystkie białka w formie natywnej (w naturalnym niezmienionym stanie, niepołączone z innymi związkami, niezdenaturowane) mają charakterystyczną dla danej cząsteczki strukturę przestrzenną, która determinuje ich właściwości i funkcję biologiczną. • Struktura I-rzędowa to sekwencja (kolejność ułożenia) aminokwasów w łańcuchu peptydowym, stabilizowana wiązaniami peptydowymi i uwarunkowana genetycznie (sekwencją nukleotydów w DNA). Konsekwencją tej struktury są następne: II-, III-, IV-rzędowa. O różnorodności białek występujących w organizmach decyduje: - liczba aminokwasów w łańcuchu polipeptydowym; - skład aminokwasowy, czyli rodzaje aminokwasów występujące w danym białku; - sekwencje aminokwasów, czyli kolejności aminokwasów w łańcuchu polipeptydowym. • Struktura II-rzędowa opisuje przestrzenne ułożenie aminokwasów tworzących rdzeń łańcucha peptydowego, bez uwzględnienia reszt bocznych – R aminokwasów. Konformacja ta jest stabilizowana głównie wiązaniami wodorowymi powstającymi między atomami węgla grupy karboksylowej – COOH i azotu grupy aminowej – NH 2. W przyrodzie powszechnie występują struktury: α-helisy i ß-harmonijki. • Konformacja α- helisy - ma kształt cylindra utworzonego przez ciasno skręcony łańcuch główny polipeptydu. Łańcuchy boczne aminokwasów wystają na zewnątrz w ułożeniu śrubowym (helikalnym). Tę konformację stabilizują wiązania wodorowe tworzące się w obrębie głównego łańcucha polipeptydowego - między wiązaniami peptydowymi występującymi co cztery reszty aminokwasowe. • Konformacja β-harmoniki (zwana również strukturą pofałdowanej kartki) - jest tworzona przez maksymalnie rozciągnięte fragmenty łańcucha polipeptydowego, które przebiegają obok siebie równolegle (tj. w tym samym kierunku) lub antyrównolegle (tj. w przeciwnych kierunkach). • Struktura III-rzędowa to przestrzenne położenie wszystkich atomów, także atomów łańcuchów bocznych łańcucha polipeptydowego. Łańcuchy polipeptydowe przyjmują na pewnych odcinkach regularne konformacje α-helisy (kształt cylindra lub wstążki) i ß-harmonijki, na innych zaś tworzy się struktura nieuporządkowana. • Strukturę tę stabilizują wiązania wodorowe, wiązania jonowe, siły van der Waalsa oraz
(…)
… są: temperatura, kwasy, alkalia, rozpuszczalniki organiczne, detergenty,
utleniacze, mocznik. Najczęściej czynniki te denaturują białka.
- Niektóre rozpuszczają się w wodzie bądź słabych roztworach soli, np. białka globularne.
- Ulegają hydrolizie pod wpływem enzymów hydrolitycznych wewnątrz komórki lub na
zewnątrz.
- Kształt przestrzenny białek decyduje bezpośrednio o ich właściwościach i funkcjach.
- Do badania składu ilościowego i jakościowego białek oraz rozdzielania na aminokwasy
służą metody elektroforezy, chromatografii i ultrawirowania.
KLASYFIKACJA BIAŁEK
Na podstawie właściwości chemicznych
wyróżniamy:
- Skleroproteiny – białka fibrylarne (włókienkowe) są
nierozpuszczalne w wodzie, mają budowę włókienkową,
służą jako substancje podporowe w organizmie, np.
keratyna, fibroina, miozyna, aktyna…
... zobacz całą notatkę






Komentarze użytkowników (0)