To tylko jedna z 3 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
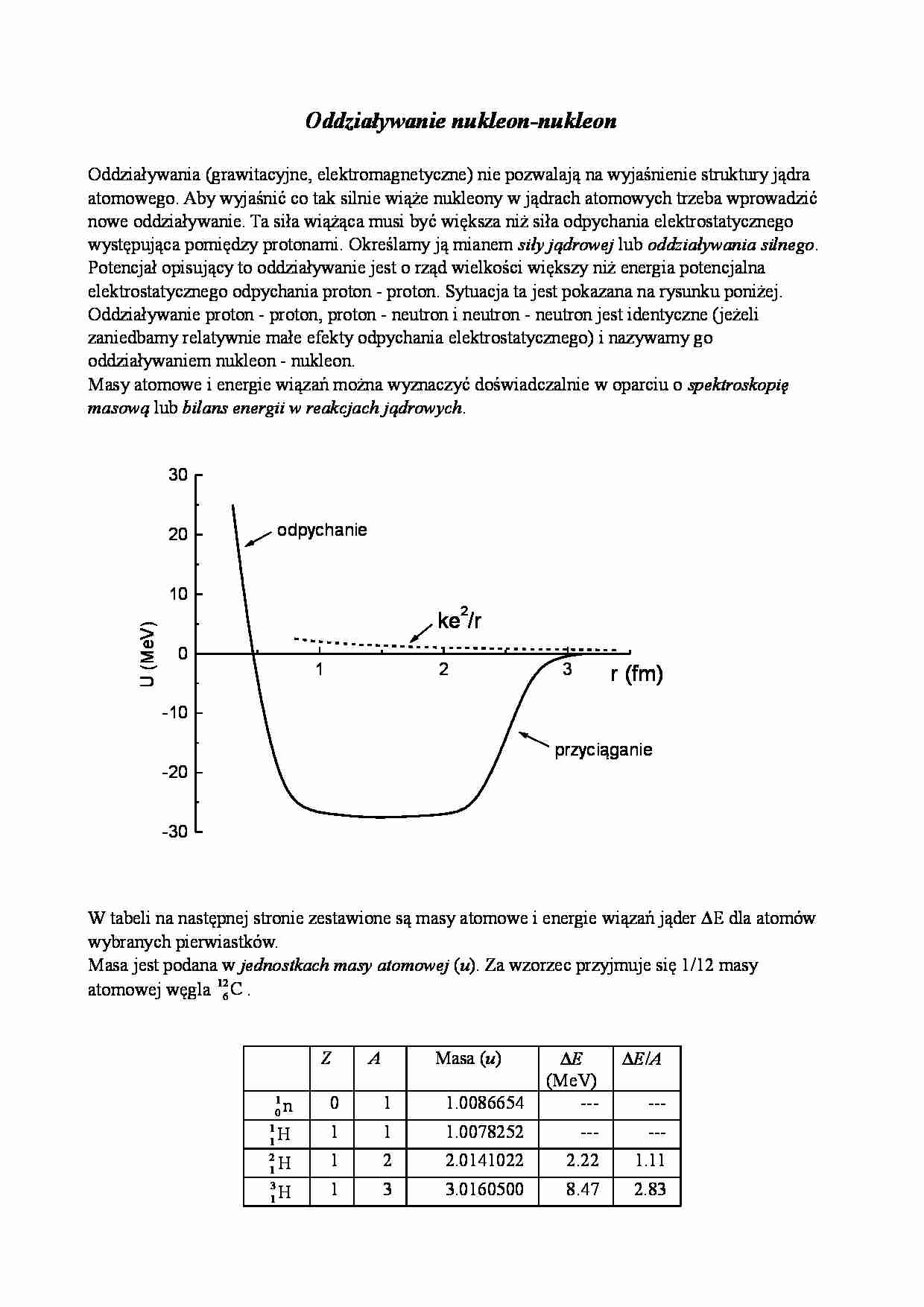


Oddziaływanie nukleon-nukleon Oddziaływania (grawitacyjne, elektromagnetyczne) nie pozwalają na wyjaśnienie struktury jądra atomowego. Aby wyjaśnić co tak silnie wiąże nukleony w jądrach atomowych trzeba wprowadzić nowe oddziaływanie. Ta siła wiążąca musi być większa niż siła odpychania elektrostatycznego występująca pomiędzy protonami. Określamy ją mianem siły jądrowej lub oddziaływania silnego . Potencjał opisujący to oddziaływanie jest o rząd wielkości większy niż energia potencjalna elektrostatycznego odpychania proton - proton. Sytuacja ta jest pokazana na rysunku poniżej. Oddziaływanie proton - proton, proton - neutron i neutron - neutron jest identyczne (jeżeli zaniedbamy relatywnie małe efekty odpychania elektrostatycznego) i nazywamy go oddziaływaniem nukleon - nukleon. Masy atomowe i energie wiązań można wyznaczyć doświadczalnie w oparciu o spektroskopię masową lub bilans energii w reakcjach jądrowych . W tabeli na następnej stronie zestawione są masy atomowe i energie wiązań jąder ∆E dla atomów wybranych pierwiastków. Masa jest podana w jednostkach masy atomowej ( u ). Za wzorzec przyjmuje się 1/12 masy atomowej węgla 6 12 C . Z A Masa ( u ) ∆ E (MeV) ∆ E / A 0 1 n 0 1 1.0086654 --- --- 1 1 H 1 1 1.0078252 --- --- 1 2 H 1 2 2.0141022 2.22 1.11 1 3 H 1 3 3.0160500 8.47 2.83 1 2 3 -30 -20 -10 0 10 20 30 ke 2/r przyciąganie odpychanie U ( M e V ) r (fm) 2 3 He 2 3 3.0160299 7.72 2.57 2 4 He 2 4 4.0026033 28.3 7.07 4 9 Be 4 9 9.0121858 58.0 6.45 6 12 C 6 12 12.0000000 92.2 7.68 8 16 O 8 16 15.994915 127.5 7.97 29 63 Cu 29 63 62.929594 552 8.50 50 120 Sn 50 120 119.9021 1020 8.02 74 184 W 74 184 183.9510 1476 8.02 92 238 U 92 238 238.05076 1803 7.58 W oparciu o dane zestawione w tabeli można uzyskać dalsze informacje o jądrach atomowych. Dla przykładu porównajmy masę atomu 2 4 He z sumą mas jego składników. M ( 2 4 He ) = 4.0026033 u Całkowita masa jego składników równa jest sumie mas dwu atomów 1 1 H i dwu neutronów tzn. 2 M ( 1 1 H ) + 2 M ( 0 1 n ) = 2·1.0078252 u + 2·1.0086654 u = 4.0329812 u Uwaga: zarówno w skład masy helu jak i dwu mas wodoru wchodzą masy dwu elektronów. Wynik: masa helu jest mniejsza od masy składników o wartość 0.0303779 u . Dla każdego atomu analogiczny rachunek pokazałby, że masa atomu jest mniejsza od masy jego składników o wielkość ∆ M zwaną niedoborem masy . Wynik ten jest świadectwem energii wiązania jąder jak i równoważności masy i energii.
(…)
…. Jest to
jedna z najważniejszych cech charakteryzujących jądro.
Zauważmy, że początkowo ∆E/A wzrasta ze wzrostem A, ale potem przybiera w przybliżeniu stałą
wartość około 8 MeV. Wyniki średniej energii wiązania na nukleon w funkcji liczby masowej jądra
A są pokazane na rysunku poniżej.
Gdyby każdy nukleon w jądrze przyciągał jednakowo każdy z pozostałych nukleonów to energia
wiązania na nukleon byłaby proporcjonalna do A.
Fakt…
... zobacz całą notatkę






Komentarze użytkowników (0)