To tylko jedna z 51 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę


Modyfikacje enzymów
Wykład 3
Produkcja białek rekombinowanych
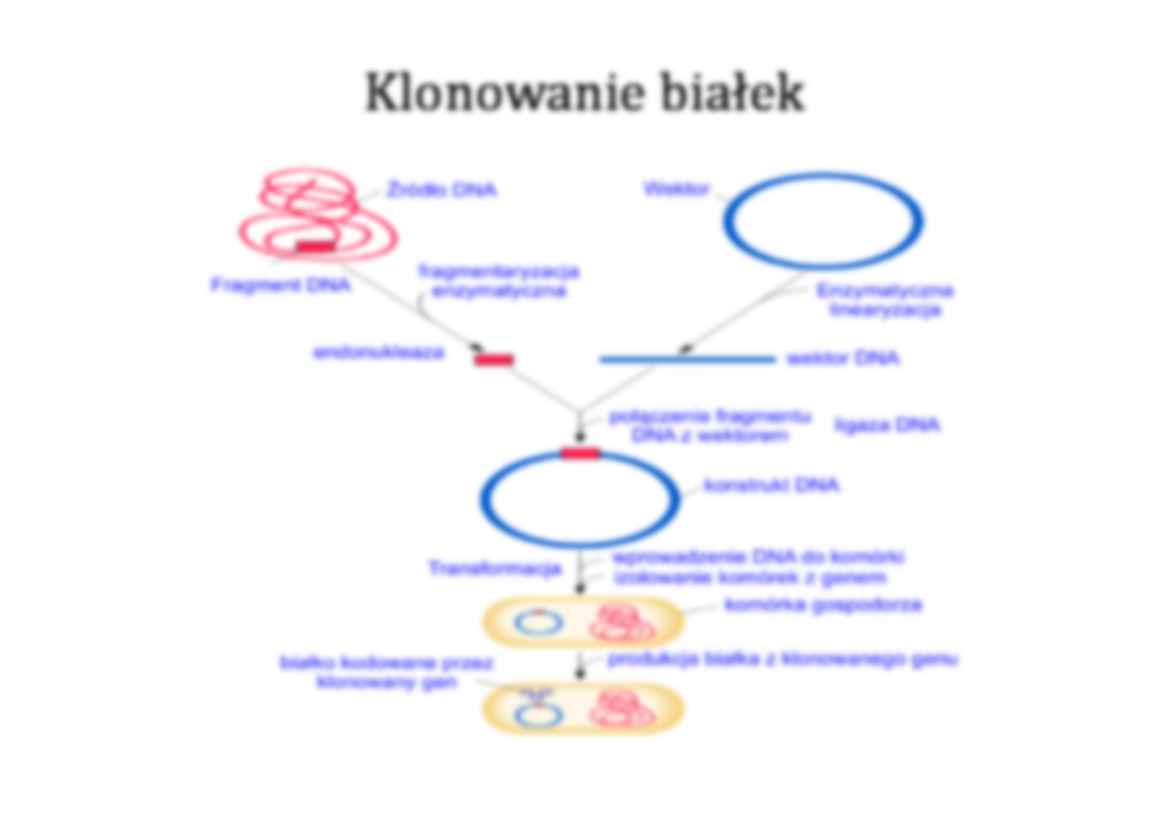
Klonowanie białek
Etapy klonowania
Wyizolowanie i oczyszczenie DNA z organizmu lub środowiska
Biblioteki cDNA (complementary) – DNA jest kopią mRNA
Biblioteki genowe - źródłem DNA jest genom
Bibliotek środowiskowe - źródłem DNA jest środowisko (np. próbka
ziemi)
Zlokalizowanie interesującego genu w wyizolowanym DNA
Zaprojektowanie primerów i miejsc restrykcyjnych do klonowania
Sklonowanie genu w odpowiednim wektorze i transformowanie nim
komórek gospodarza (np. Escherichia coli, Saccharomyces cerevisae, Pichia
pastoris)
Zsekwencjonowanie klonu, aby potwierdzić prawidłową sekwencję
wprowadzonego genu
Ekspresja białka
Wybór systemu do ekspresji
Escherichia coli jest najlepiej poznanym i najczęściej wykorzystywanym
mikroorganizmem w ekspresji białek:
Łatwa manipulacja genetyczna
Dostępne handlowo są dziesiątki szczepów i wektorów
Rośnie łatwo i niedrogo
Wiele białek jest przez nią dobrze tolerowanych
Jest wysoce wydajna
Status GRS (generally-regarded-as-safe)
Ale nie jest uniwersalna: ekspresję białka, które wymaga posttranslacyjnej
modyfikacji np. glikozydacji, wydajnego tworzenia wiązania disulfidowego,
specyficznych procesów proteolitycznych, lepiej będzie przeprowadzić
w komórkach eukariotycznych, problemem także jest częste powstawania białek
w formie nierozpuszczalnej
Inne systemy ekspresji białek: Saccharomyces cerevisiae, Pilchia pastoris,
Lactococcus lactis
Wybór systemu do ekspresji w E.coli
Rozmiar białka – najlepszej ekspresji ulegają białka lub polipeptydy
cytozolowe w postaci białek fuzyjnych o masie do 70kDa, większe mogą
być niestabilne
Ilość białka – nie można przewidzieć czy dane białko będzie z dużą
wydajnością ulegało ekspresji, najlepiej zoptymalizować proces używając
różnych kombinacji wektor-gospodarz
Gdzie wydzielone białko będzie wykorzystane – do badań
strukturalnych lub aktywności enzymatycznej najodpowiedniejsze
będzie białko ulegające ekspresji w formie rozpuszczalnej lub
wydzielenie go z frakcji nierozpuszczalnej
Na co należy zwrócić uwagę
Transcriptional start
Translational start
Na co należy zwrócić uwagę
Szczep gospodarza – nie można dowolnie łączyć wektora ze
szczepem gospodarza
Promotor – silny/słaby, indukowany/konstytutywny; promotor
umiejscowiony przed miejscem wprowadzenia sekwencji
kodującej
Liczba kopii plazmidu – więcej plazmidów = więcej informacji
= większa ekspresja
Stabilność mRNA – struktura drugorzędowa, ważna zwłaszcza
na końcu 5’
Sygnał do translacji - sekwencja Shine-Dalgaro
Na co należy zwrócić uwagę
Terminator transkrypcji – ważne żeby był efektywny, najlepiej
podwójny zaczynający się od sekwencji UAAU
„Codon usage” – kodony rzadkie dla E.coli mogą zaburzyć
ekspresję
Selekcja - odpowiedni antybiotyk może mieć wpływ na
ekspresję
Temperatura – zasadniczy wpływ na stabilność i strukturę
białka
Warunki hodowli – poziom tlenu, szybkość wzrostu, źródło
węgla, wymiana ciepła itp.
Najpopularniejsze szczepy E.coli
Wektor
... zobacz całą notatkę






Komentarze użytkowników (0)