To tylko jedna z 8 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
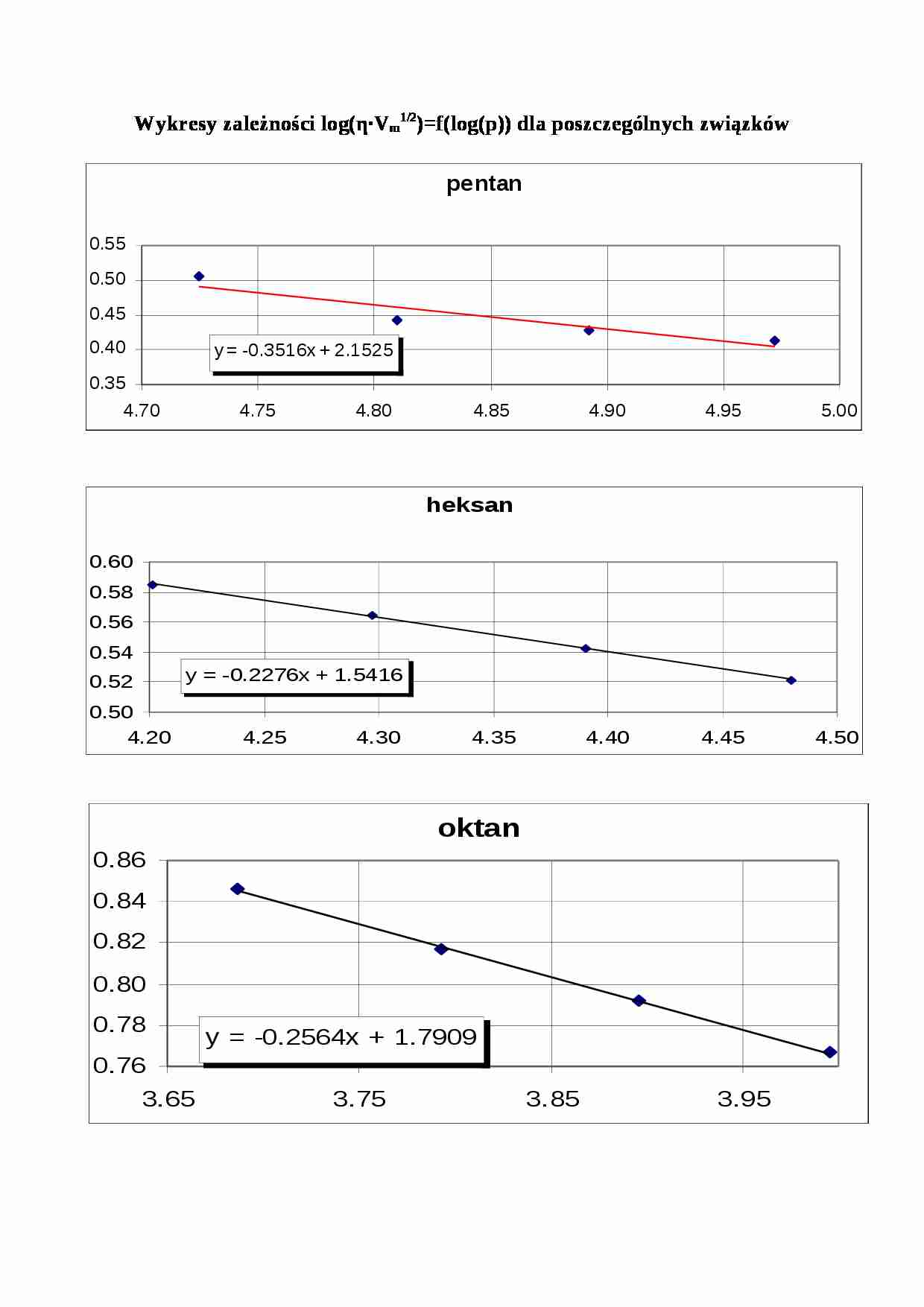


Wykresy zależności log(η∙Vm1/2)=f(log(p)) dla poszczególnych związków
Sprawozdanie semestralne
Fizykochemiczna charakterystyka substancji czystych. Część II.
Prężność pary. Lepkość.
Rafał Ruzik
Grzegorz Krakowski
Jakub Ziętek
Prężność pary
W układach jednoskładnikowych dwufazowych w stanie równowagi w warunkach p,T=const., potencjały chemiczne obu faz są sobie równe. Ponieważ taki układ ma jeden stopień swobody więc zmiana ciśnienia powoduje zmianę temperatury.
Parą nasyconą nazywamy fazę gazową w równowadze z cieczą. Równanie Clapeyrona stosowane do równowagi ciecz - para ma postać:
są to odpowiednio entalpia ΔHW i objętość ΔVW molowa parowania. Obie te wielkości są dodatnie, są większe niż dla cieczy. Dlatego pochodna (dP/dH)W jest zawsze dodatnia i prężność pary nasyconej wzrasta ze wzrostem temperatury. Aby otrzymać wzór wyrażający prężność pary jako funkcję temperatury, trzeba scałkować równanie, co wymaga wprowadzenia przybliżeń, stanowiących założenia ekstratermodynamiczne.
Zaniedbujemy objętość molową cieczy Vcm jako dużo mniejszą od objętości molowej pary
Przyjmujemy, że para jest gazem doskonałym
Te dwa założenia sprowadzają równanie Clapeyrona do postaci :
Rozdzielamy zmienne i wykorzystujemy pewne tożsamości :
Scałkowanie powyższych równań wymaga znajomości entalpii parowania jako funkcji temperatury. Jeżeli rozważany przedział temperatury nie jest zbyt duży, można przyjąć dodatkowe przybliżenie, że entalpia parowania jest niezależna od temperatury. Całkując przy tym założeniu w granicach P1-P2 i T1-T2 otrzymujemy:
Często stosowane jest równanie korelacyjne, oparte na powyższym równaniu Clausiusa-Clapeyrona:
A i B - stałe dla danej substancji
Zależność ta jest liniowa dla niezbyt dużych zakresów temperatur, co wynika z przyjętych założeń upraszczających. Przybliżenie danych doświadczalnych w znacznie szerszym zakresie daje równanie Antoine'a w postaci:
A,B i C - stałe dla danej substancji
Trouton sformułował potwierdzone empiryczne ogólnie dotyczące stosunkowi ΔH do normalnej temperatury wrzenia:
(…)
… to jest spowodowane możliwością asocjacji cząsteczek alkoholi ze względu na występujące wiązania wodorowe w fazie ciekłej i brak asocjacji w fazie gazowej. Powoduje to ograniczenie swobody ruchu cząsteczek cieczy, a w związku z tym zmniejszenie jej entropii w porównaniu z entropią cieczy niezasocjowanej. Dla alkanów podobnie jak i alkoholi wraz z liczbą atomów węgla w cząsteczce rośnie entalpia parowania i normalna…
… temperatury wrzenia:
Odstępstwa od tej reguły wykazują związki ulegające asocjacji spowodowanej m.in. powstawaniem wiązania wodorowego.
Lepkość
Lepkość jest wielkością charakteryzującą płyny, związane z procesami dynamicznymi. Przesuwanie warstewek cieczy względem siebie, wskutek istnienia międzycząsteczkowych sił przyciągających, napotyka na opór, który nazywamy tarciem wewnętrznym. Aby przesunąć warstwę…
… kinetycznej v, zdefiniowanej jako :
Jednostką jej jest m2∗s-1. Lepkość wyznacza się, mierząc objętość cieczy przepływającą przez wąską rurkę w określonym czasie. Wpływ na lepkość cieczy mają oddziaływania międzycząsteczkowe. A.I.Baczyński podał równanie uzależniające lepkość cieczy od objętości molowej:
c, ω - stałe zależne od rodzaju cieczy, a niezależne od temperatury i ciśnienia
Wielkość ω stanowi ułamek…
…:
.
Zależność ln η od 1/T jest więc liniowa.
Pomiar prężności pary
Pomiar był wykonywany metodą ebuliometryczną, za pomocą ebuliometru Świętosławskiego. Składa on się z podstawowych elementów: grzałki, chłodnicy, pompki Cotrella, gniazda z termometrem. Dodatkowo w skład układu pomiarowego wchodzą : pompka wodna, manometr, manostat. Dzięki grzałce ciecz ulega zagrzaniu do temperatury wrzenia, a następnie wrząca…
... zobacz całą notatkę






Komentarze użytkowników (0)