

Fragment notatki:
Ćwiczenie „Bioreaktor mikrobiologiczny”
Cel ćwiczenia: Wyznaczanie właściwej szybkości wzrostu oraz współczynników
stechiometrycznych na przykładzie szczepu Bacillus licheniformis wykorzystującego glukozę,
jako źródło węgla i energii.
Wzrost mikroorganizmów to bardzo złożony proces. We wnętrzu komórek zachodzi
wiele, powiązanych ze sobą przemian enzymatycznych o skomplikowanej kinetyce.
Uwzględnienie wszystkich tych relacji stechiometrycznych i kinetycznych jest bardzo
skomplikowane, dlatego też do opisu wzrostu mikroorganizmów wykorzystuje się jedynie
najbardziej istotne zależności występujące w czasie wzrostu danej populacji.
Wzrost mikroorganizmów można rozpatrywać jako bardzo złożoną przemianę, w której
tworzona jest biomasa i produkty metabolizmu.
Jednym z najważniejszych parametrów, który określa szybkość wzrostu biomasy
mikroorganizmów jest właściwa szybkość wzrostu (µ) zdefiniowana jako:
µ=
1 dX
⋅
X dt
(1)
gdzie: X-stężenie biomasy [g l-1]
t – czas [h]
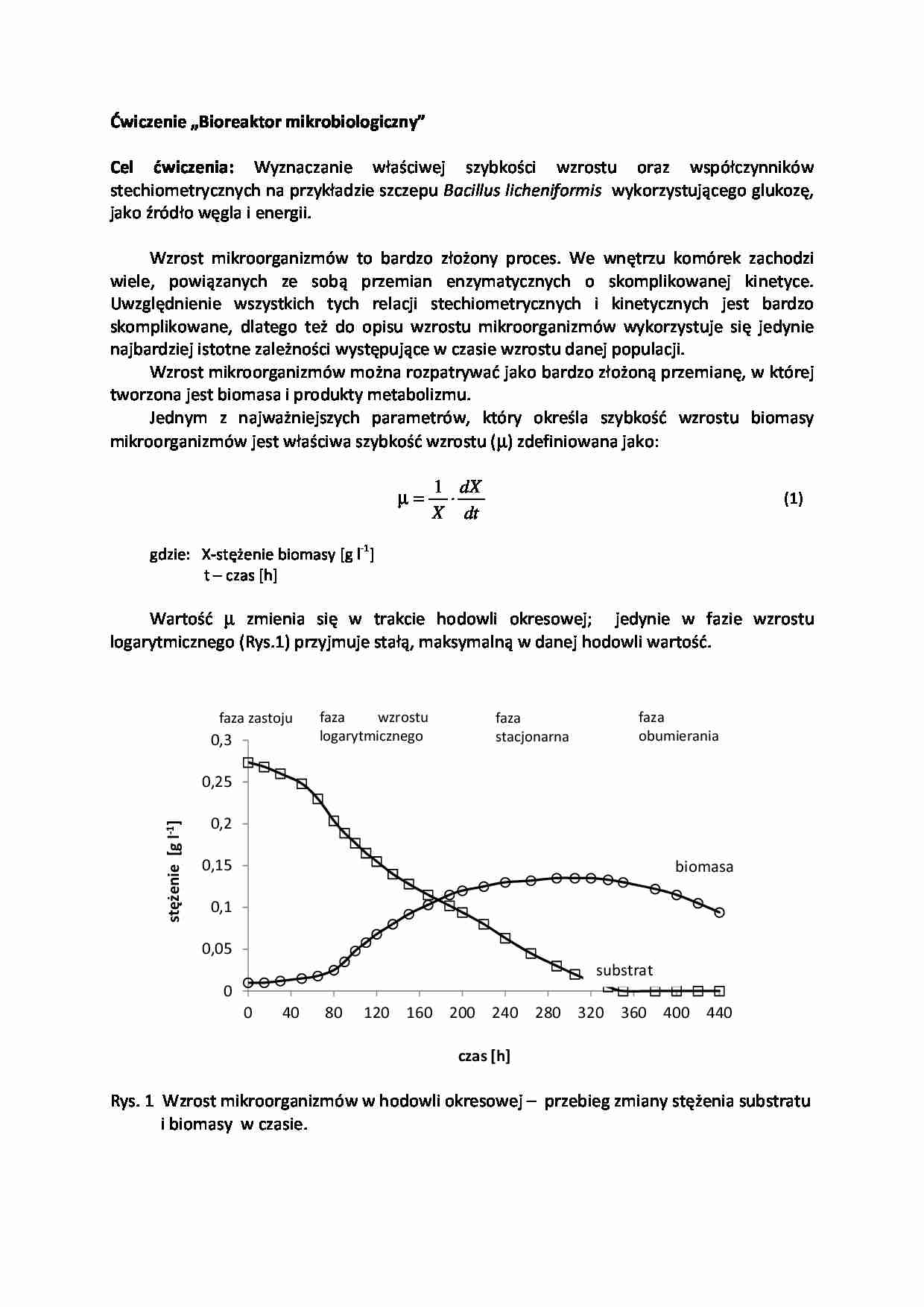
Wartość µ zmienia się w trakcie hodowli okresowej; jedynie w fazie wzrostu
logarytmicznego (Rys.1) przyjmuje stałą, maksymalną w danej hodowli wartość.
faza zastoju
0,3
faza
wzrostu
logarytmicznego
faza
stacjonarna
faza
obumierania
stężenie [g l-1]
0,25
0,2
0,15
biomasa
0,1
0,05
substrat
0
0
40
80
120 160 200 240 280 320 360 400 440
czas [h]
Rys. 1 Wzrost mikroorganizmów w hodowli okresowej – przebieg zmiany stężenia substratu
i biomasy w czasie.
W fazie wzrostu logarytmicznego wzrost podlega zasadom kinetyki I rzędu względem
stężenia biomasy. Równanie (1) sprowadza się do postaci (2), gdzie właściwa szybkość
wzrostu jest odpowiednikiem stałej szybkości reakcji.
dX
(2)
= µ⋅ X
dt
Po scałkowaniu równania (2) dla zakresu odpowiadającego wzrostowi logarytmicznemu
uzyskuje się zależność:
(3)
ln X 2 − ln X 1 = µ ⋅ (t 2 − t1 )
gdzie: X1, X2- graniczne stężenie biomasy w obrębie wzrostu logarytmicznego [g l-1]
t1, t2- czasy odpowiadające odpowiednio X1, X2 [h]
Wartość właściwej szybkości wzrostu jest zależna od szczepu mikroorganizmów,
warunków fizycznych (T, pH, siła jonowa) oraz jest funkcją stężenia substratu (ów) (zwykle
substratu węglowego stanowiącego główne źródło węgla i energii, nazywane substratem
limitującym). Najprostszym, ale najczęściej spotykanym modelem opisującym relację
właściwej szybkości wzrostu i stężenia substratu limitującego jest model przedstawiony przez
Monoda:
µ=
µ max ⋅ cS
K S + cS
(4)
gdzie: cS -stężenie substratu limitującego[g l-1]
KS - stała Monoda [g l-1]
µmax – maksymalna szybkość wzrostu [h-1]
Zależność ta, analogiczna
schematycznie na Rys. 2.
do
równania
Michaelisa-Menten,
przedstawiona
jest
µ
µmax
KS
cS
Rys. 2 Zależność właściwej szybkości wzrostu od stężenia substratu limitującego opisana
modelem Monoda.
Stałe powyższego równania kinetycznego można wyznaczyć zarówno przy
wykorzystaniu wyników z hodowli okresowej, jak i z hodowli ciągłej. Realizacja hodowli
ciągłej jest znacznie bardziej skomplikowana, aniżeli hodowli okresowej, stąd przynajmniej
wstępne wartości stałych wyznacza się na podstawie danych z hodowli okresowej.
Przebieg ćwiczenia:
Badania prowadzi się w termostatowanym (37oC) bioreaktorze wyposażonym
w mieszadło mechaniczne, które zapewnia pseudohomogeniczność układu, przy
odpowiednim natlenieniu hodowli. Wszystkie elementy bioreaktora, jak i pożywka
poddawane są uprzednio sterylizacji (1210C).
Schematycznie
układ badawczy
przedstawiono na Rys. 3.
rotametr
pobór próbek
powietrze
sterylne
Rys. 3 Schemat bioreaktora mieszalnikowego do hodowli wgłębnej pracującego w systemie
okresowym.
Sposób przeprowadzenia eksperymentu
Do bioreaktora o pojemności 2,5 dm3 wprowadza się 1,5 dm3 pożywki mineralnej o
składzie na 1 litr: NaNO3 3 g, KH2PO4 3 g, K2HPO4 6 g, (NH4)2SO4 10 g, MgSO4 0,01 g, MnSO4
0,01 g, CaCl2 0,01 g, ZnSO4 0,001 g, FeSO4 0,001 g, cytrynian trójsodowy 1g i poddaje
sterylizacji w autoklawie (1210C) przez 1h. Równocześnie w osobnym naczyniu sterylizuje się
roztwór glukozy (150 g l-1).
Hodowlę rozpoczyna się poprzez dodanie odpowiedniej ilości glukozy do sterylnej
pożywki mineralnej, tak aby w poszczególnych hodowlach okresowych uzyskać stężenie
początkowe cukru 1-10 g l-1 i zaszczepienie reaktora bezpośrednio z płytki agarowej (2 pełne
oczka ezy lub hodowli płynnej ok. 5% objętości reaktora).
Po dobrym wymieszaniu układu należy pobrać pierwsze próby do analizy stężenia
glukozy i stężenia biomasy. Następne próby pobiera się w odstępach
kilkudzięciominutowych, do momentu pełnego wyczerpania glukozy, zwracając uwagę na
wysoką częstość poboru prób w fazie wzrostu logarytmicznego.
Stężenie komórek oznacza się spektrofotometrycznie poprzez pomiar mętności (OD)
hodowli, przy 550 nm względem wody. Krzywa standardowa dla uzyskana metodą suchej
masy dla Bacillus licheniformis opisana jest równaniem A(550nm) =4,286 . X [g/l], gdzie Xstężenie biomasy. Wszystkie pomiary należy wykonać przynajmniej w dwukrotnym
powtórzeniu nie przekraczając wartości absorbancji 1,0.
Stężenie substratu węglowego (glukozy) oznacza się poprzez test DNS, dla prób
uprzednio odwirowanych (3000 obr./min, 15 min.).
Do 0,5 ml odwirowanego medium hodowlanego należy dodać 1,5 ml odczynnika DNS
i próby wstawić na 5 min. do łaźni wodnej o temp. 1000C. Następnie próby należy szybko
ochłodzić, dodać 8 ml wody destylowanej i po 25 min od wyciągnięcia z łaźni zmierzyć
absorbancję przy 550 nm względem kontroli. Próbę kontrolną uzyskuje się poprzez dodanie
0,5 ml wody destylowanej zamiast 0,5 ml medium traktując następnie próbę kontrolną, jak
wszystkie pozostałe. Krzywa standardowa dla glukozy opisana jest równaniem
A(550nm)=0,65 . cS [g/l] -0,02. Zakres stosowalności równania 0,1-1,6 g l-1. Jeżeli stężenie
cukru w próbie pobranej z reaktora przekracza 1,6 g l-1, przed wykonaniem testu należy
rozcieńczyć je wodą destylowaną odpowiednią ilość razy.
Dla prób odwirowanych oznacza się również spektrofotometrycznie względem wody,
przy 280nm stężenie białka wytwarzanego przez szczep. Krzywa standardowa opisana jest
równaniem A(280nm) = 0,982 . c [g/l], gdzie c-stężenie białka. Wszystkie pomiary należy
wykonać przynajmniej w dwukrotnym powtórzeniu nie przekraczając wartości absorbancji
1,0.
Opracowanie wyników
Wyniki uzyskane w trakcie hodowli zbiera się w formie tabelarycznej (Tab.1), z której
następnie wykreśla się wykres X=f(t), cS=f(t), cb=f(t).
Tab.1 Zestawienie wyników analiz podczas hodowli okresowej.
Czas
hodowli
[h]
A (550nm)
rozcieńczenie
X
-1
[g l ]
DNS(550nm)
rozcieńczenie
-1
cS [g l ]
A (280nm)
rozcieńczenie
1.
2.
W celu obliczenia wartości µ sporządza się dodatkowo wykres pomocniczy (Rys. 4), na
którym odznacza się odcinek prostoliniowy odpowiadający najwyższej wartości µ.
czas [h]
0
-0,5
0
25
50
75
100
125
150
175
ln X
-1
-1,5
-2
-2,5
-3
-3,5
Rys. 4 Zmiana stężenia komórek w czasie (wykres logarytmiczny).
200
225
-1
Cb [g l ]
Dla przedstawionego przypadku uzyskana ze współczynnika kierunkowego prostej
(Rys.4) wartość µ wyniosła 0,0503 [h-1]. Odcinek prosty został wykreślony ze stężenia
biomasy w czasie 19-23,5 h hodowli. Średnie stężenie glukozy w tym przedziale czasu
wynosiło 0,581 g l-1. Uzyskaną parę punktów (0,581; 0,0503) wraz z analogicznie uzyskanymi
punktami z kolejnych hodowli okresowych nanosi się na wykres przedstawiony na Rys. 5.
0,1
µ [ −1]
[h
0,08
0,06
0,04
0,02
0
0
2
4
6
stężenie glukozy [g l-1]
8
10
Rys. 5 Zależność właściwej szybkości wzrostu od stężenia substratu.
Po linearyzacji równania Monoda (równ.(5)) w prosty sposób znajduje się wartości
szukanych stałych (Ks, µmax) (Rys.7).
1 KS 1
1
=
⋅ +
µ µ max cS µ max
(5)
Dodatkowo ze zmian stężenia komórek, białka i substratu w czasie (opisując te
zmiany odpowiednimi równaniami) należy wyznaczyć współczynniki stechiometryczne YX/S i
YPr/S. Należy przyjąć tylko ten zakres, dla którego widoczna jest zmiana stężenia komórek czy
białka w czasie lub też jeżeli hodowla jest skończona (koniec substratu, spadek biomasy,
białka) przyjąć czas trwania całej hodowli. Opisanie punktów doświadczalnych równaniami a
nie liczenie po krańcowych punktach „znosi” błąd analityczny.
... zobacz całą notatkę

Komentarze użytkowników (0)