ZASADA PAULIEGO
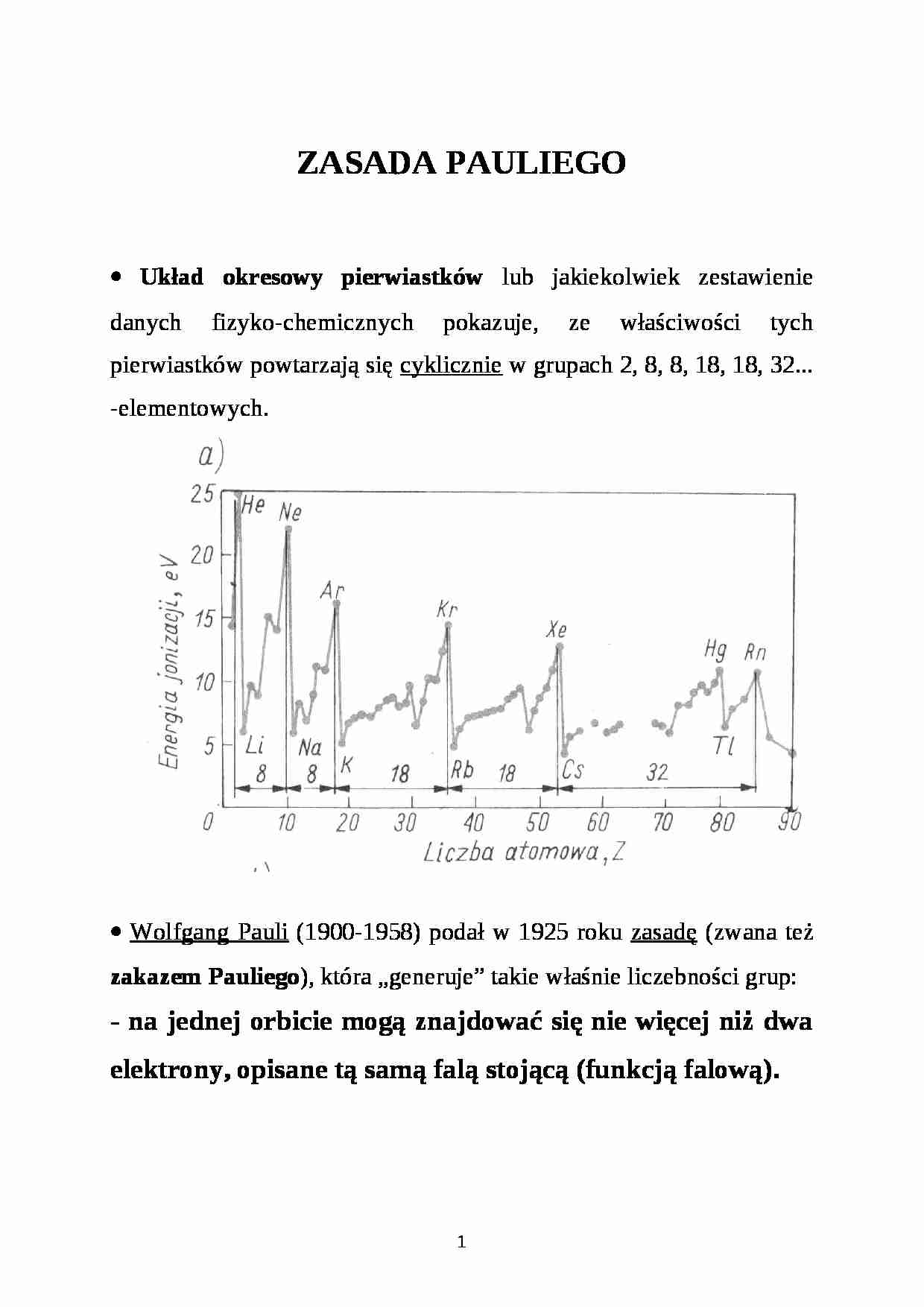
• Układ okresowy pierwiastków lub jakiekolwiek zestawienie danych fizyko-chemicznych pokazuje, ze właściwości tych pierwiastków powtarzają się cyklicznie w grupach 2, 8, 8, 18, 18, 32... -elementowych.
• Wolfgang Pauli (1900-1958) podał w 1925 roku zasadę (zwana też zakazem Pauliego), która „generuje” takie właśnie liczebności grup:
- na jednej orbicie mogą znajdować się nie więcej niż dwa elektrony, opisane tą samą falą stojącą (funkcją falową).
ZASADA PAULIEGO - c.d.
• Zasada Pauliego była wprowadzona empirycznie (bez dowodu ani uzasadnienia), ale dobrze wyjaśniała opisywaną liczebność grup (razem z istniejącą już kwantową teorią atomu i pojęciem liczb kwantowych):
dla (główna liczna kwantowa) mamy jedną możliwość: i - czyli dwa elektrony;
dla może być już: i , co daje dokładnie cztery kombinacji: (2,0,0), (2,1,-1), (2,1,0) i (2,1,2) a więc zgodnie z zasadą Pauliego osiem elektronów;
dla dochodzi pięć nowych kombinacji: (3,2,-2), (3,2,-1), (3,2,0), (3,2,1) i (3,2,2) co daje w sumie dziewięć kombinacji i osiemnaście funkcji elektronowych.
SPIN ELEKTRONU
• Zaledwie rok później odkryto, że wszystkie elektrony mają wewnętrzny (a więc nie związany z ruchem o orbicie wokół atomu) moment pędu równy:
który nazwany został spinowym momentem pędu. • Elektron zachowuje się więc jakby był wirującą kulką o ustalonym momencie pędu, równym połowie naturalnej jednostki momentu pędu ! Ten wewnętrzny moment pędu nie zwiększa się ani nie maleje. Później okazało się również, że istnieją inne cząstki elementarne, których spin też równy jest .
• P.M. Dirac i W. Pauli stworzyli po odkryciu spinu elektronu relatywistyczną teorię kwantową dla cząstek o spinie ½ i stwierdzili, że z warunków niezmienniczości wynikają funkcje falowe elektronów, które spełniają zasadę Pauliego - cząstka o takim spinie może mieć składowe momentu pędu wzdłuż osi tylko równe lub - do opisu funkcji falowej elektronu doszła jeszcze jedna liczna kwantowa.
ATOMY WIELOELEKTRONOWE
• Równanie Schrödingera i zasada Pauliego stanowią podstawy teorii, dzięki której możemy przewidzieć właściwości pierwiastków bez przeprowadzania doświadczeń chemicznych!
• W praktyce często łatwiej jednak wykonać doświadczenie niż przeprowadzać żmudne i czasochłonne obliczenia komputerowe...
• Dla wodoru (liczba atomowa
(…)
… elektrostatyczna jest równa 1,8 eV dla odległości między atomami równej 8 Å - wtedy elektron „przeskakuje” z atomu litu do fluoru.
WIĄZANIA CZĄSTECZEK
• Wiązania kowalencyjne: (rozpowszechnione w cząsteczkach organicznych) polegają na „uwspólnieniu” elektronów z zewnętrznych powłok przez oba atomy, wiążące się ze sobą.
Wiązania kowalencyjne występują wtedy, gdy mamy do czynienia z pewną „symetrią” zagadnienia…
... zobacz całą notatkę





Komentarze użytkowników (0)