Grzegorz Zdziebło 12.05.2009 Krzysztof Warzecha Gr P6 zespół F lab 11
Liczby przenoszenia 1.Cel ćwiczenia Celem ćwiczenia jest teoretyczne i praktyczne opanowanie metody pomiaru liczb przenoszenia oraz poznanie zasad działania kulometrów. 2.Przyrządy i odczynniki: Naczynie elektrolityczne, kulometr srebrowy, zasilacz stabilizowany, miliamperomierz, elektrody srebrowe, szkło laboratoryjne, 0.05M AgNO 3 , ok. 20% KNO 3 , 2M HNO 3 , 0.1M NH 4 SCN, ok. 10% ałun żelazowo - amonowy.
3.Wykonanie ćwiczenia Ćwiczenie polega na określeniu liczb przenoszenia jonów srebrowych oraz azotanowych metodą Hittorfa. Wykonuje się je przy użyciu aparatu przedstawionego na Rys.1.
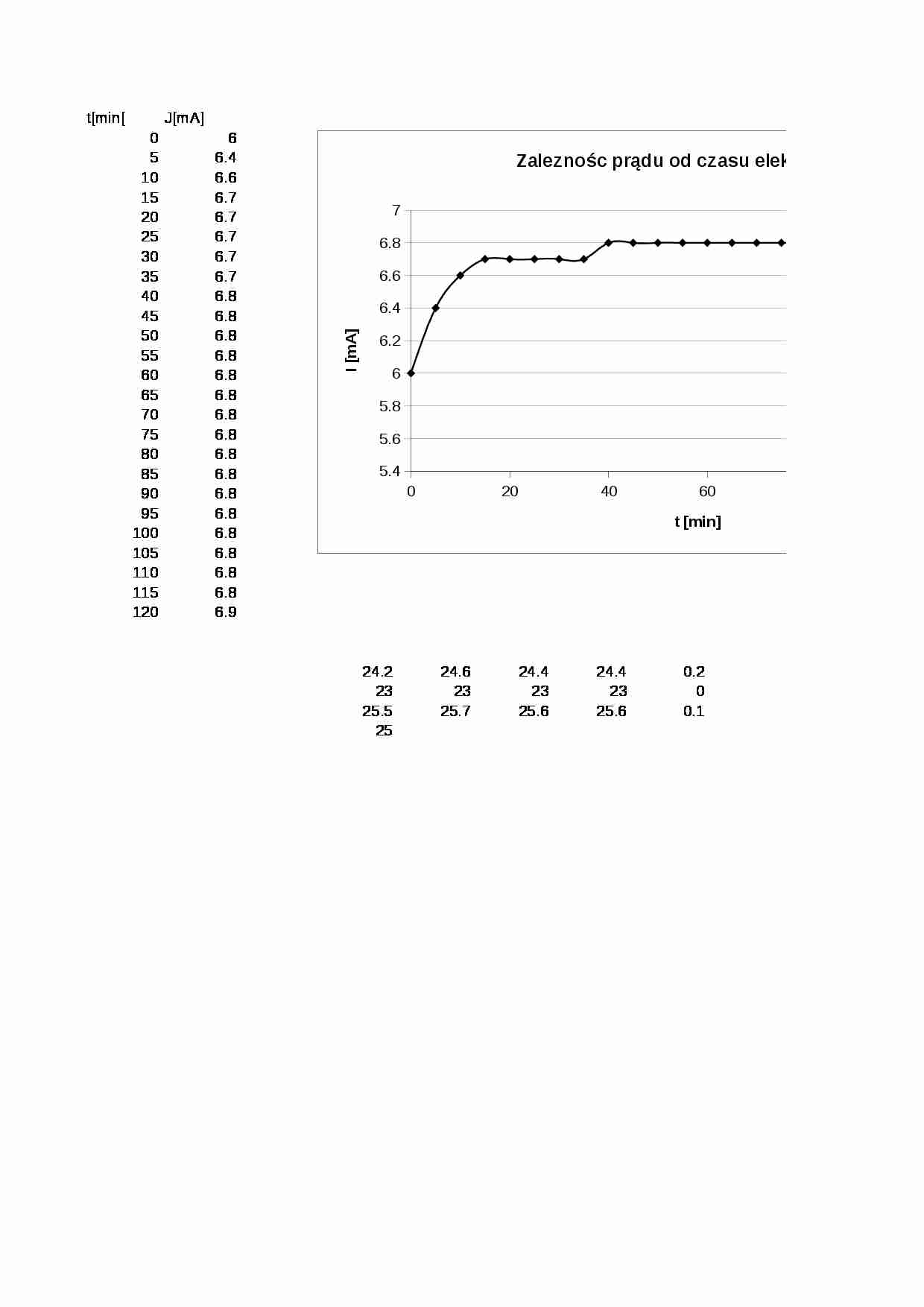
W celu wykonania ćwiczenia należy przeprowadzić następujące czynności: Przepłukać naczyńko elektrolityczne wodą destylowaną a następnie napełnić je 0.05 M roztworem AgNO 3 i umieścić w nim elektrody srebrne. Do kulometru nalać 20 %-wag. roztworu KNO 3 , tak aby jego poziom sięgał 2 cm poniżej elektrody platynowej. Następnie, za pomocą pipety, dotykając jej końcem ścianki naczynia, ostrożnie wlać 0.5 M roztwór HNO 3 . Nie wolno dopuścić do wymieszania się cieczy! Po zmontowaniu obwodu elektrycznego i podłączeniu do źródła prądu ustalić w obwodzie natężenie prądu na poziomie ok. 6-7 mA. Elektrolizę AgNO 3 prowadzić przez 2 godziny. Rejestrować natężenie prądu w funkcji czasu (sporządzić wykres zależności natężenia prądu od czasu podczas elektrolizy).
W tym czasie oznaczyć dokładnie stężenie roztworu AgNO 3 . W tym celu pobrać 10 ml roztworu wyjściowego do erlenmajerki i zmiareczkować 0.02M roztworem rodanku amonu NH 4 SCN metodą Volharda (opis poniżej). Po skończonej elektrolizie zamknąć zawór znajdujący się w środkowej części elektrolizera, oddzielający część katodową od anodowej. Do cylindra miarowego zebrać anolit a po dokładnym zmierzeniu jego objętości i wymieszaniu pobrać 10 ml i oznaczyć stężenie srebra. Analogicznie oznaczyć stężenie srebra w katolicie. Wyjąć elektrody z kulometru, przepłukać je woda destylowaną zbierając ciecz do erlenmajerki, do której przenieść następnie ilościowo całość roztworu z kulometru. Oznaczyć stężenie srebra.
4. Opracowanie wyników :
4.1 Pomiar natężenia prądu w funkcji czasu w procesie elektrolizy AgNO 3. t[min[
J[mA]
0
6
5
6,4
10
6,6
15
6,7
20
6,7
25
6,7
30
6,7
35
6,7
40
6,8
45
6,8
50
6,8
55
(…)
…- ) = ( c - b + a ) / a
tAg+ = ( 218,5-231,8+25)/25= 0,468
tNO3- = 1 - tAg+=0,532
4.3 Analiza niepewności odczytów:
a)pomiar objętości pipetą 10 ml :u(V)= ± 0,1ml
b)pomiar czasu :u(t)= ±1s
c)pomiar natężenia prądu elektrycznego :u(I)=0,05mA
Błąd standardowy dla średniej obliczamy z następującego wzoru: Gdzie
n- liczba powtórzonych miareczkowań, jest wielkością próbki
xi- poszczególne argumenty: V1, V2. V3…
… (1,602*10-19C)
η= lepkość dynamiczna wody 297 K=9,142 *10-3 Pauz = 9,142 *10-4 Pa *s
ui= ruchliwość jonów 5* 10-8 [m2V-1s-1] =1,86 Å
Rteor=1.86 Å
Napięcie
[V]
Natężenie pola elektrycznego
[Vcm-1]
Prędkość wędrówki
[cms-1]
Ruchliwość
jonów
[cm2V-1s-1]
Przewodnictwo
jonowe
Promień jonu
MnO4- [m]
70
1,7045
0,00062
0,0005
48,25
1,86 Å
100
2,2727
0,00085
150
3,4091
0,00148
Wnioski
W ćwiczeniu…
... zobacz całą notatkę



Komentarze użytkowników (0)