To tylko jedna z 3 stron tej notatki. Zaloguj się aby zobaczyć ten dokument.
Zobacz
całą notatkę
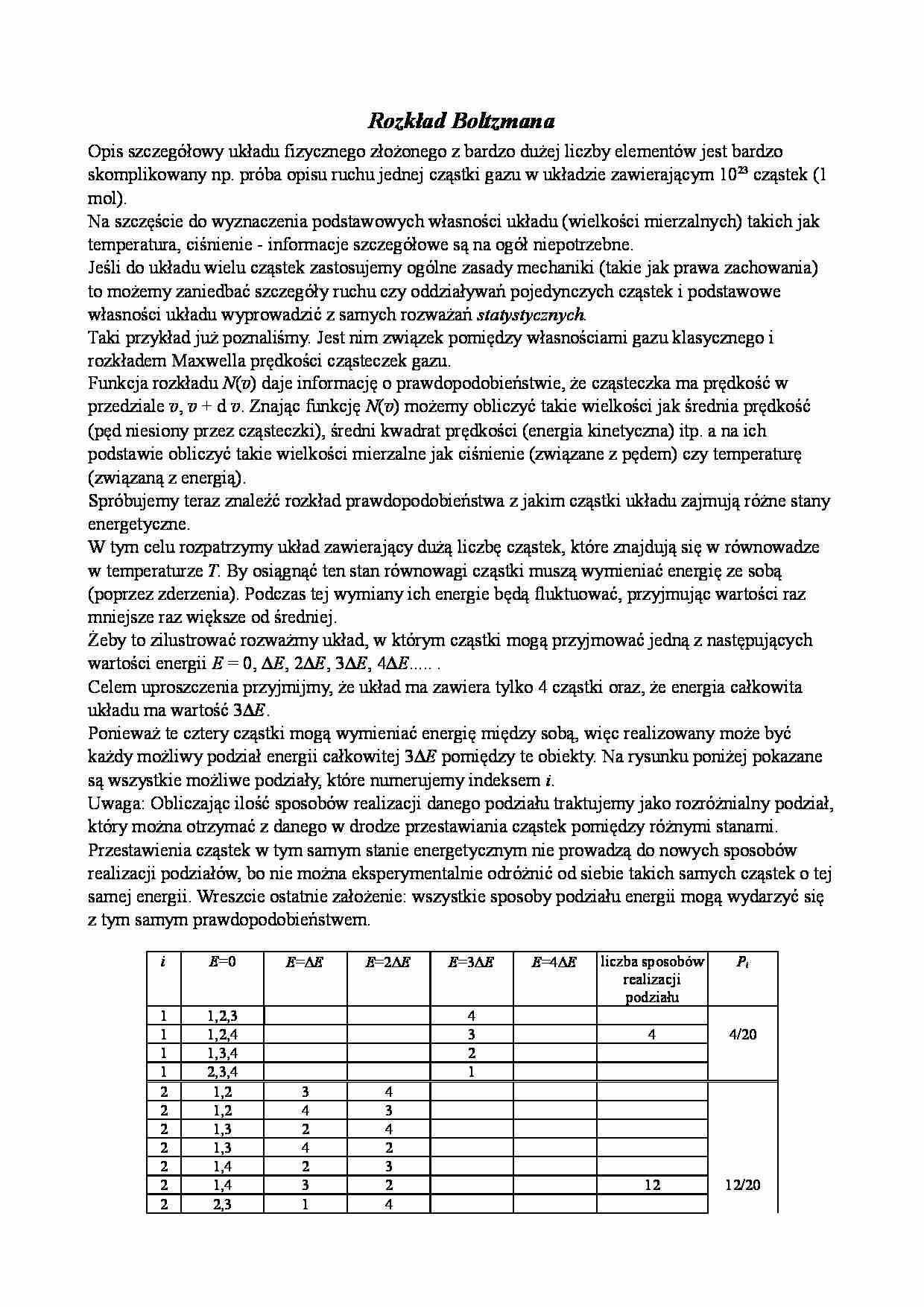


Rozkład Boltzmana Opis szczegółowy układu fizycznego złożonego z bardzo dużej liczby elementów jest bardzo skomplikowany np. próba opisu ruchu jednej cząstki gazu w układzie zawierającym 1023 cząstek (1 mol). Na szczęście do wyznaczenia podstawowych własności układu (wielkości mierzalnych) takich jak temperatura, ciśnienie - informacje szczegółowe są na ogół niepotrzebne. Jeśli do układu wielu cząstek zastosujemy ogólne zasady mechaniki (takie jak prawa zachowania) to możemy zaniedbać szczegóły ruchu czy oddziaływań pojedynczych cząstek i podstawowe własności układu wyprowadzić z samych rozważań statystycznych. Taki przykład już poznaliśmy. Jest nim związek pomiędzy własnościami gazu klasycznego i rozkładem Maxwella prędkości cząsteczek gazu. Funkcja rozkładu N ( v ) daje informację o prawdopodobieństwie, że cząsteczka ma prędkość w przedziale v , v + d v . Znając funkcję N ( v ) możemy obliczyć takie wielkości jak średnia prędkość (pęd niesiony przez cząsteczki), średni kwadrat prędkości (energia kinetyczna) itp. a na ich podstawie obliczyć takie wielkości mierzalne jak ciśnienie (związane z pędem) czy temperaturę (związaną z energią). Spróbujemy teraz znaleźć rozkład prawdopodobieństwa z jakim cząstki układu zajmują różne stany energetyczne. W tym celu rozpatrzymy układ zawierający dużą liczbę cząstek, które znajdują się w równowadze w temperaturze T . By osiągnąć ten stan równowagi cząstki muszą wymieniać energię ze sobą (poprzez zderzenia). Podczas tej wymiany ich energie będą fluktuować, przyjmując wartości raz mniejsze raz większe od średniej. Żeby to zilustrować rozważmy układ, w którym cząstki mogą przyjmować jedną z następujących wartości energii E = 0, ∆ E , 2∆ E , 3∆ E , 4∆ E ..... . Celem uproszczenia przyjmijmy, że układ ma zawiera tylko 4 cząstki oraz, że energia całkowita układu ma wartość 3 ∆ E . Ponieważ te cztery cząstki mogą wymieniać energię między sobą, więc realizowany może być każdy możliwy podział energii całkowitej 3 ∆ E pomiędzy te obiekty. Na rysunku poniżej pokazane są wszystkie możliwe podziały, które numerujemy indeksem i . Uwaga: Obliczając ilość sposobów realizacji danego podziału traktujemy jako rozróżnialny podział, który można otrzymać z danego w drodze przestawiania cząstek pomiędzy różnymi stanami. Przestawienia cząstek w tym samym stanie energetycznym nie prowadzą do nowych sposobów realizacji podziałów, bo nie można eksperymentalnie odróżnić od siebie takich samych cząstek o tej samej energii. Wreszcie ostatnie założenie: wszystkie sposoby podziału energii mogą wydarzyć się
(…)
….
Wykres zależności n(E) jest pokazany na rysunku poniżej.
Ciągła krzywa na rysunku jest wykresem malejącej wykładniczo funkcji
n( E ) = Ae
−
E
E0
Możemy teraz brać ∆E coraz mniejsze (zwiększając ilość dozwolonych stanów) przy tej samej co
poprzednio wartości całkowitej energii. Oznacza to, że będziemy dodawać coraz więcej punktów do
naszego wykresu, aż w granicy gdy ∆E → 0 przejdziemy do funkcji ciągłej…
... zobacz całą notatkę






Komentarze użytkowników (0)